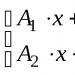Penelitian Nuklir Dubna. Fluorida adalah gas kuning pucat yang beracun dan reaktif. Klorin adalah gas berat, beracun, berwarna hijau muda dengan bau klorin yang tidak sedap. Brom, cairan beracun berwarna merah kecokelatan yang dapat merusak saraf penciuman, terkandung dalam ampul karena. memiliki sifat volatilitas. Yodium adalah kristal ungu-hitam beracun yang mudah disublimasikan. Astatin adalah kristal radioaktif berwarna biru kehitaman, periode isotop terpanjang adalah 8,1 jam. Semua halogen bereaksi dengan hampir semua halogen zat sederhana, dengan pengecualian beberapa. Mereka adalah oksidator yang energik, sehingga hanya dapat ditemukan dalam bentuk senyawa. Aktivitas kimia halogen menurun dengan meningkatnya nomor atom. Halogen memiliki aktivitas oksidasi yang tinggi, yang menurun ketika berpindah dari fluor ke yodium. Yang paling aktif adalah fluor, yang bereaksi dengan semua logam. Banyak logam di atmosfer unsur ini terbakar dan terlepas secara spontan jumlah besar kehangatan. Tanpa pemanasan, fluor dapat bereaksi dengan banyak non-logam, dan semua reaksi bersifat . Fluor bereaksi dengan gas mulia () ketika disinari. Klorin bebas, meskipun aktivitasnya lebih kecil dibandingkan fluor, juga sangat reaktif. Klorin dapat bereaksi dengan semua zat sederhana kecuali oksigen, nitrogen dan gas inert. Elemen ini bereaksi dengan banyak hal zat kompleks, substitusi dan adisi dengan hidrokarbon. Ketika dipanaskan, klor menggantikan brom, serta yodium, dari senyawanya dengan logam atau hidrogen. Aktivitas kimianya juga cukup tinggi, meskipun lebih kecil dibandingkan dengan fluor atau klor, sehingga brom terutama digunakan keadaan cair dan konsentrasi awalnya, jika hal-hal lain dianggap sama, lebih besar daripada konsentrasi klorin. Demikian pula, unsur ini larut dalam air dan, bereaksi sebagian dengannya, menghasilkan “ air bromin“Yodium berbeda dalam aktivitas kimianya dengan halogen lainnya. Ia tidak dapat bereaksi dengan sebagian besar non-logam, dan hanya bereaksi dengan logam ketika dipanaskan dan sangat lambat. Reaksinya sangat reversibel dan endotermik. Yodium tidak larut dalam air dan bahkan ketika dipanaskan tidak dapat mengoksidasinya, sehingga “air yodium” tidak ada. Yodium dapat larut dalam larutan iodida untuk membentuk anion kompleks. Astatin bereaksi dengan hidrogen dan logam. Aktivitas kimia halogen menurun secara berturut-turut dari fluor menjadi yodium. Setiap halogen menggantikan halogen berikutnya dari senyawanya dengan logam atau hidrogen, mis. setiap halogen dalam bentuk zat sederhana dapat mengoksidasi ion halogen dari salah satu halogen berikut.
Dari buku pelajaran kimia, banyak orang mengetahui bahwa halogen termasuk unsur kimia tabel periodik Mendeleev dari grup 17 di tabel.
Diterjemahkan dari bahasa Yunani sebagai kelahiran, asal. Hampir semuanya sangat aktif, sehingga bereaksi hebat dengan zat sederhana, kecuali beberapa non-logam. Apa itu halogen dan apa sifat-sifatnya?
Daftar halogen
Halogen merupakan oksidator yang baik; oleh karena itu, di alam halogen hanya dapat ditemukan pada senyawa tertentu. Semakin tinggi nomor serinya, semakin besar aktivitas kimia Ada lebih sedikit elemen dalam grup ini. Kelompok halogen mencakup unsur-unsur berikut:
- klorin (Cl);
- fluor (F);
- yodium (saya);
- brom (Br);
- astatin (Pada).
Yang terakhir ini dikembangkan di institut penelitian nuklir, yang terletak di kota Dubna. Fluor adalah gas beracun dengan warna kuning pucat. Klorin juga beracun. Merupakan gas yang mempunyai bau agak menyengat dan tidak sedap, berwarna hijau muda. Brom memiliki warna coklat kemerahan dan merupakan cairan beracun bahkan dapat mempengaruhi indera penciuman. Ini sangat mudah menguap, sehingga disimpan dalam ampul. Yodium adalah zat berwarna ungu tua yang berbentuk kristal, mudah disublimasikan. Astatin bersifat radioaktif, warna kristal: hitam dengan biru, waktu paruh 8,1 jam.
 Aktivitas oksidasi halogen yang tinggi menurun dari fluor menjadi yodium. Yang paling aktif dari saudaranya adalah fluor, yang memiliki kemampuan untuk bereaksi dengan logam apa pun, membentuk garam, beberapa di antaranya terbakar secara spontan, melepaskan panas dalam jumlah besar. Tanpa pemanasan, unsur ini bereaksi dengan hampir semua nonlogam, reaksi disertai dengan pelepasan sejumlah panas (eksotermik).
Aktivitas oksidasi halogen yang tinggi menurun dari fluor menjadi yodium. Yang paling aktif dari saudaranya adalah fluor, yang memiliki kemampuan untuk bereaksi dengan logam apa pun, membentuk garam, beberapa di antaranya terbakar secara spontan, melepaskan panas dalam jumlah besar. Tanpa pemanasan, unsur ini bereaksi dengan hampir semua nonlogam, reaksi disertai dengan pelepasan sejumlah panas (eksotermik).
Fluor berinteraksi dengan gas inert dan diiradiasi (Xe + F 2 = XeF 2 + 152 kJ). Saat dipanaskan, fluor mempengaruhi halogen lain, mengoksidasinya. Rumusnya berlaku: Hal 2 + F 2 = 2HalF, di mana Hal = Cl, Br, I, At, jika bilangan oksidasi HalF dari klor, brom, yodium dan astatin sama dengan + 1.
Fluor juga berinteraksi cukup kuat dengan zat kompleks. Konsekuensinya adalah oksidasi air. Dalam hal ini terjadi reaksi eksplosif yang secara singkat ditulis dengan rumus: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2.
Klorin
Aktivitas klorin bebas sedikit lebih rendah dibandingkan aktivitas fluor, tetapi ia juga memiliki aktivitas kemampuan yang baik bereaksi. Hal ini dapat terjadi ketika berinteraksi dengan banyak zat sederhana, dengan pengecualian yang jarang terjadi dalam bentuk oksigen, nitrogen, dan gas inert. Dia dapat bereaksi hebat dengan zat kompleks, menciptakan reaksi substitusi, sifat penambahan hidrokarbon juga melekat pada klorin. Ketika dipanaskan, brom atau yodium digantikan dari senyawa dengan hidrogen atau logam.
 Unsur ini mempunyai hubungan yang khas dengan hidrogen. Pada suhu kamar dan tanpa paparan cahaya, klorin tidak bereaksi dengan cara apa pun terhadap gas ini, namun begitu dipanaskan atau diarahkan ke cahaya, reaksi berantai yang eksplosif akan terjadi. Rumusnya diberikan di bawah ini:
Unsur ini mempunyai hubungan yang khas dengan hidrogen. Pada suhu kamar dan tanpa paparan cahaya, klorin tidak bereaksi dengan cara apa pun terhadap gas ini, namun begitu dipanaskan atau diarahkan ke cahaya, reaksi berantai yang eksplosif akan terjadi. Rumusnya diberikan di bawah ini:
Cl2+ Hν → 2Cl, Cl + H2 → HCl + H, H + Cl2 → HCl + Cl, Cl + H2 → HCl + H, dst.
Foton, ketika tereksitasi, menyebabkan penguraian molekul Cl 2 menjadi atom, dan terjadi reaksi berantai, menyebabkan munculnya partikel baru yang memulai permulaan tahap berikutnya. Dalam sejarah kimia fenomena ini telah dipelajari. Ahli kimia dan pemenang hadiah Rusia Hadiah Nobel Semenov N.N. pada tahun 1956 dia mempelajari foto berantai reaksi kimia dan dengan demikian memberikan kontribusi besar bagi sains.
Klorin bereaksi dengan banyak zat kompleks, yaitu reaksi substitusi dan adisi. Ini larut dengan baik dalam air.
Cl 2 + H 2 O = HCl + HClO - 25 kJ.
Dengan basa, bila dipanaskan, klorin bisa tidak proporsional.
Brom, yodium dan astatin
Aktivitas kimia brom sedikit lebih rendah dibandingkan dengan fluor atau klor yang disebutkan di atas, tetapi juga cukup tinggi. Brom sering digunakan dalam bentuk cair. Ini, seperti klorin, larut dengan baik dalam air. Reaksi parsial terjadi dengannya, memungkinkan seseorang memperoleh “air bromin”.
Aktivitas kimia yodium sangat berbeda dari perwakilan lain dari seri ini. Ia hampir tidak berinteraksi dengan non-logam, tetapi dengan Dengan logam, reaksinya terjadi sangat lambat dan hanya jika dipanaskan. Dalam hal ini terjadi penyerapan panas dalam jumlah besar (reaksi endotermik), yang sangat reversibel. Di samping itu Yodium tidak dapat dilarutkan dalam air dengan cara apapun, hal ini tidak dapat dicapai bahkan dengan pemanasan, itulah sebabnya “air beryodium” tidak ada di alam. Yodium hanya dapat dilarutkan dalam larutan iodida. Dalam hal ini, anion kompleks terbentuk. Dalam dunia kedokteran, senyawa ini disebut larutan Lugol.
Astatin bereaksi dengan logam dan hidrogen. Dalam rangkaian halogen, aktivitas kimia menurun dari fluor ke astatin. Setiap halogen pada deret F - At mampu menggantikan unsur-unsur berikutnya dari senyawa dengan logam atau hidrogen. Astatin adalah unsur yang paling pasif. Namun hal ini ditandai dengan interaksi dengan logam.
Aplikasi
Kimia tertanam kuat dalam kehidupan kita, merambah ke segala bidang. Manusia telah belajar menggunakan halogen, serta senyawanya, untuk keuntungannya sendiri. Signifikansi biologis halogen tidak dapat disangkal. Area penerapannya berbeda:
- obat-obatan;
- farmakologi;
- produksi berbagai plastik, pewarna, dll;
- pertanian.
 Terbuat dari senyawa alami kriolit, rumus kimia yang terlihat seperti ini: Na3AlF6, dapatkan aluminium. Senyawa fluor banyak digunakan dalam produksi pasta gigi. Fluorida diketahui membantu mencegah karies. Tingtur alkohol yodium digunakan untuk desinfeksi dan desinfeksi luka.
Terbuat dari senyawa alami kriolit, rumus kimia yang terlihat seperti ini: Na3AlF6, dapatkan aluminium. Senyawa fluor banyak digunakan dalam produksi pasta gigi. Fluorida diketahui membantu mencegah karies. Tingtur alkohol yodium digunakan untuk desinfeksi dan desinfeksi luka.
Klorin telah menemukan penggunaan paling luas dalam kehidupan kita. Ruang lingkup penerapannya cukup beragam. Contoh penggunaan:
- Produksi plastik.
- Kuitansi asam klorida.
- Produksi serat sintetis, pelarut, karet, dll.
- Pemutihan kain (linen dan katun), kertas.
- Disinfeksi air minum. Namun ozon semakin banyak digunakan untuk tujuan ini, karena penggunaan klorin berbahaya bagi tubuh manusia.
- Disinfeksi tempat
Harus diingat bahwa halogen sangat banyak zat beracun. Sifat ini terutama terlihat pada fluor. Halogen dapat menyebabkan sesak napas, iritasi pernafasan dan merusak jaringan biologis.
Uap klorin bisa sangat berbahaya, begitu pula aerosol fluor, yang memiliki bau samar dan dapat dirasakan dalam konsentrasi tinggi. Seseorang mungkin mengalami efek mati lemas. Saat bekerja dengan koneksi seperti itu, tindakan pencegahan harus dilakukan.
Metode untuk memproduksi halogen sangat kompleks dan beragam. Dalam industri, hal ini didekati dengan persyaratan tertentu yang dipatuhi dengan ketat.
Mari kita bicara tentang apa itu halogen. Mereka berada di kelompok ketujuh (subkelompok utama) dari tabel periodik. Diterjemahkan dari bahasa Yunani"halogen" berarti "penghasil garam". Dalam artikel tersebut kita akan bicara tentang apa itu halogen kimia, zat apa yang digabungkan dalam istilah ini, apa sifat dan ciri produksinya.
Keunikan
Saat membahas apa itu halogen, kami memperhatikan struktur spesifik atomnya. Semua unsur mempunyai tujuh elektron pada tingkat energi terluarnya, salah satunya tidak berpasangan (bebas). Oleh karena itu, mereka diungkapkan dengan jelas sifat pengoksidasi halogen, yaitu penambahan satu elektron selama interaksi dengan berbagai zat, yang mengarah pada penyelesaian eksternal sepenuhnya tingkat energi, pembentukan konfigurasi halida stabil. Dengan logam mereka membentuk ikatan kuat yang bersifat ionik.

Perwakilan halogen
Ini termasuk elemen berikut: fluor, klor, brom, yodium. Yang secara formal terkait dengan mereka adalah astatin dan tennesin. Untuk memahami apa itu halogen, perlu diperhatikan bahwa klor, brom, dan yodium memiliki orbital bebas. Dialah yang menjelaskan berbagai derajat oksidasi unsur-unsur ini. Misalnya, klorin memiliki nilai sebagai berikut: -1, +1, +3, +5, +7. Ketika energi tambahan diberikan ke atom klor, terjadi transfer elektron secara bertahap, yang menjelaskan perubahan bilangan oksidasi. Di antara konfigurasi klorin yang paling stabil adalah senyawanya, yang bilangan oksidasinya -1 dan +7.

Berada di alam
Ciri strukturalnya menjelaskan prevalensinya di alam. Senyawa halogen di alam disajikan dalam bentuk halida, sangat larut dalam air. Dengan peningkatan jari-jari atom halogen terjadi penurunan kandungan kuantitatifnya kerak bumi. Misalnya, beberapa senyawa brom, klor, dan fluor digunakan dalam jumlah industri.
Senyawa fluor utama yang ditemukan di alam adalah kalsium fluorida (fluorit).

Fitur penerimaan
Untuk memahami apa itu halogen, perlu diketahui cara mendapatkannya. Pilihan utama untuk memisahkan halogen murni dari garam adalah elektrolisis garam cair. Misalnya ketika natrium klorida terkena konstan arus listrik Tidak hanya gas klor, tetapi juga logam natrium dapat dianggap sebagai produk reaksi. Reduksi logam terjadi di katoda, dan halogen terbentuk di anoda. Untuk mendapatkan brom, air laut digunakan dengan cara elektrolisis larutan ini.
Sifat fisik
Mari kita memikirkan sifat fisik dari perwakilan kelompok ketujuh dari subkelompok utama. Fluor dalam kondisi normal berupa zat gas dengan warna kuning muda dan bau yang menyengat dan mengiritasi. Klorin berwarna kuning-hijau juga berbentuk gas dan memiliki warna kuning yang tajam dan menyesakkan. Brom adalah cairan berat berwarna coklat. Dari semua halogen, hanya yodium zat kristal warna ungu.
Yang paling banyak zat pengoksidasi kuat adalah fluor. Sebagai suatu golongan, kemampuan untuk memperoleh elektron selama reaksi kimia secara bertahap menurun dari fluor menjadi astatin. Alasan melemahnya sifat ini adalah peningkatan jari-jari atom.

Fitur sifat kimia
Fluor, sebagai zat pengoksidasi paling kuat, mampu berinteraksi dengan hampir semua non-logam tanpa pemanasan tambahan. Prosesnya disertai dengan pelepasan panas dalam jumlah besar. Pada logam, prosesnya ditandai dengan penyalaan sendiri fluor.
Karena halogen ini sangat aktif secara kimia, ia mampu berinteraksi dengan gas mulia ketika diiradiasi.
Fluor juga berinteraksi dengan zat kompleks. Brom memiliki aktivitas yang jauh lebih rendah. Ini terutama digunakan di kimia organik untuk melaksanakan reaksi kualitatif menjadi senyawa tak jenuh.
Yodium bereaksi dengan logam hanya jika dipanaskan, dan prosesnya ditandai dengan penyerapan energi (reaksi eksotermik).
Fitur penggunaan
Apa pentingnya halogen? Untuk menjawab pertanyaan ini, mari kita pertimbangkan bidang utama penerapannya. Misalnya, mineral kriolit alami, yang merupakan senyawa aluminium, fluor, natrium, digunakan sebagai bahan tambahan dalam pasta gigi, membantu mencegah karies.
Klorin masuk dalam jumlah besar digunakan dalam produksi asam klorida. Selain itu, halogen ini banyak diminati dalam pembuatan plastik, pelarut, pewarna, karet, dan serat sintetis. Sejumlah besar senyawa yang mengandung klorin digunakan untuk mengendalikan berbagai hama tanaman secara efektif. Klorin serta senyawanya juga diperlukan untuk proses pemutihan kain katun dan linen, kertas, dan desinfektan air minum. Brom dan yodium digunakan dalam industri kimia dan farmasi.
DI DALAM akhir-akhir ini Alih-alih klorin, ozon mulai digunakan untuk memurnikan air minum.
Tindakan biologis
Tingginya reaktivitas halogen menjelaskan fakta bahwa semua senyawa tersebut merupakan racun yang mempunyai efek menyesakkan dan dapat menginfeksi. kain organik. Terlepas dari karakteristik ini, unsur-unsur ini diperlukan untuk proses vital tubuh manusia.
Misalnya, fluor terlibat dalam proses metabolisme di sel saraf, otot, kelenjar. Peralatan masak teflon yang salah satu komponennya adalah fluor, semakin banyak digunakan dalam kehidupan sehari-hari.
Klorin meningkatkan pertumbuhan rambut, merangsang proses metabolisme, memberi kekuatan dan semangat pada tubuh. Kuantitas maksimum itu termasuk dalam plasma darah dalam bentuk natrium klorida. Diantara koneksinya dari elemen ini Asam klorida sangat menarik dari sudut pandang biologis.
Dialah yang menjadi dasarnya jus lambung, berpartisipasi dalam proses pemecahan makanan. Agar tubuh dapat berfungsi normal, seseorang harus mengonsumsi garam meja minimal dua puluh gram per hari.
Semua halogen diperlukan untuk kehidupan manusia dan juga digunakan dalam daerah yang berbeda kegiatan.
Semua unsur dalam tabel periodik Mendeleev digabungkan menjadi beberapa kelompok, bergantung pada sifat kimianya. Pada artikel ini kita akan melihat apa itu halogen (atau halogen).
Arti halogen
Halogen adalah unsur-unsur dari tabel periodik golongan 17 Mendeleev, dan menurut klasifikasi usang - 7 dari subkelompok utama. Halogen hanya mencakup 5 unsur kimia, termasuk fluor, klor, yodium, astatin, dan brom. Semuanya bukan logam. Halogen adalah zat pengoksidasi yang sangat aktif, dan tingkat eksternal Unsur-unsur ini mempunyai 7 elektron.
Apa itu halogen, mengapa mendapat nama ini? Kata "halogen" berasal dari dua kata Yunani yang jika digabungkan berarti "kelahiran garam". Salah satu unsur dalam golongan ini, klor, membentuk garam bersama dengan natrium.
Sifat fisik golongan halogen
Mirip, tapi berbeda karakteristik fisik elemennya berbeda satu sama lain.
Fluor adalah zat berbentuk gas kuning, dengan sangat tidak menyenangkan dan bau yang menyengat. Klorin adalah gas berwarna hijau-kuning dengan bau yang menyengat dan menjijikkan. Brom adalah cairan berwarna coklat. Astatin adalah padatan berwarna biru kehitaman dengan bau yang menyengat. Yodium - abu-abu Dengan merangkum informasi di atas, kita dapat menjawab pertanyaan: “Apa itu halogen?” Ini termasuk gas, cairan, dan padatan.

Sifat kimia golongan halogen
Utama milik bersama Hal yang hebat tentang semua halogen adalah bahwa mereka semua merupakan zat pengoksidasi yang sangat aktif. Halida yang paling aktif adalah fluor, yang bereaksi dengan semua logam, dan yang paling tidak aktif adalah astatin.
Interaksi dengan halogen dalam zat sederhana (dengan pengecualian beberapa nonlogam) terjadi dengan mudah. Di alam hanya ditemukan dalam bentuk senyawa.
Fluor
Fluor seperti itu hanya diperoleh di akhir XIX abad oleh seorang ilmuwan Perancis bernama Henri Moissan. Fluor adalah gas berwarna kuning pucat. Halogen adalah tipikal non-logam dan zat pengoksidasi, dan fluor adalah yang paling aktif dari semua halogen. Sekarang halogen ini sangat diperlukan dalam industri karena digunakan dalam pembuatan pipa, pita listrik, berbagai pelapis kain, permukaan anti lengket untuk penggorengan dan cetakan, dan dalam pengobatan dalam pembuatan arteri dan vena buatan. Dalam industri, halogen ini diencerkan dengan nitrogen.

Klorin
Klorin terkenal unsur kimia, termasuk dalam kelompok halogen. Kita telah membahas di atas apa itu halogen. Klorin menghemat sifat dasar elemen grup Anda.
Itu mendapat namanya dari kata Yunani"chloros", yang berarti hijau pucat. Gas ini tersebar luas di alam; ditemukan dalam jumlah besar di air laut. Klorin adalah unsur kimia yang sangat penting; secara praktis sangat diperlukan untuk pemutihan, desinfeksi kolam renang, dan desinfeksi air minum.
Namun klorin juga dikenal sebagai senjata yang mematikan. Pada tahun 1915 pasukan Jerman digunakan melawan tentara Perancis sekitar 6 ribu silinder dengan halogen ini. Ini senjata mematikan ditemukan oleh ahli kimia Jerman terkenal Fritz Haber.

Yodium
Yodium, atau yodium, adalah unsur kimia lain yang termasuk dalam kelompok halogen. Faktanya, dalam tabel periodik unsur ini disebut tidak lebih dari yodium, tetapi ia nama yang sepele yodium dianggap Nama unsur tersebut berasal dari kata Yunani, yang diterjemahkan ke dalam bahasa Rusia berarti “ungu”. Unsur kimia ini adalah kehidupan sehari-hari cukup sering terjadi. Ketika direaksikan dengan halogen lain, terutama klorin, ia menghasilkan disinfektan yang sangat baik untuk luka dan goresan. Sekarang yodium digunakan dalam pengobatan untuk mencegah penyakit tiroid.
Astatin
Astatin menarik karena belum pernah diproduksi oleh ahli kimia dalam jumlah sedemikian sehingga dapat dilihat dengan mata telanjang. Dan kemungkinan besar, peluang ini tidak akan pernah muncul di hadapan mereka. Sekalipun para ahli dapat memperoleh unsur kimia ini dalam jumlah besar, unsur tersebut akan segera menguap karena suhu tinggi yang timbul sebagai akibatnya. radiasi radioaktif elemen ini. Astatin adalah unsur kimia paling langka, dan sejumlah kecil ditemukan di kerak bumi.
Di antara halogen, astatin adalah unsur yang tidak berguna karena saat ini tidak ada gunanya ditemukan untuk itu.
Penerapan dan makna
Terlepas dari kenyataan bahwa semua halogen memiliki sifat kimia yang serupa, mereka digunakan di bidang yang sangat berbeda. Misalnya, fluorida sangat bermanfaat untuk gigi, itulah sebabnya fluorida ditambahkan ke pasta gigi. Penggunaan agen terapeutik dan profilaksis yang mengandung unsur kimia fluor mencegah terjadinya karies. Klorin digunakan untuk menghasilkan asam klorida, yang sangat diperlukan dalam industri dan pengobatan. Klorin digunakan untuk membuat karet, plastik, pelarut, pewarna, dan serat sintetis. Senyawa yang mengandung unsur ini digunakan dalam pertanian untuk pengendalian hama. Klorin halogen sangat diperlukan untuk memutihkan kertas dan kain. Penggunaan klorin untuk mengolah air minum dianggap tidak aman. Brom, yang merupakan halogen, dan yodium sering digunakan dalam pengobatan.

Pentingnya halogen dalam kehidupan manusia sangat besar. Jika kita membayangkan keberadaan umat manusia tanpa halogen, maka kita akan kehilangan hal-hal seperti foto, antiseptik dan desinfektan, karet, plastik, linoleum dan banyak lagi lainnya. Selain itu, zat-zat ini diperlukan agar tubuh manusia dapat berfungsi secara normal, yaitu berperan penting peran biologis. Meskipun sifat halogen serupa, perannya dalam industri dan pengobatan berbeda.
Sifat fisik halogen
Dalam kondisi normal, gas F2 dan C12, cairan Br2, I2 dan At2- padatan. Dalam keadaan padat, halogen membentuk kristal molekul. Dielektrik halogen cair. Semua halogen, kecuali fluor, larut dalam air; Yodium kurang larut dibandingkan klorin dan brom, tetapi sangat larut dalam alkohol.
Sifat kimia halogen
Semua halogen menunjukkan aktivitas oksidasi tinggi, yang menurun ketika berpindah dari fluor ke astatin. Fluor adalah halogen yang paling aktif, bereaksi dengan semua logam tanpa kecuali, banyak di antaranya terbakar secara spontan di atmosfer fluor, melepaskan sejumlah besar panas, misalnya:
2Al + 3F2 = 2AlF3 + 2989 kJ,
2Fe + 3F2 = 2FeF3 + 1974 kJ.
Tanpa pemanasan, fluor juga bereaksi dengan banyak non-logam (H2, S, C, Si, P) - semua reaksi sangat eksotermik, misalnya:
H2 + F2 = 2HF + 547 kJ,
Si + 2F2 = SiF4(g) + 1615 kJ.
Ketika dipanaskan, fluor mengoksidasi semua halogen lainnya sesuai dengan skema
Hal2 + F2 = 2SetengahF
dimana Hal = Cl, Br, I, At, dan dalam senyawa HalF bilangan oksidasi klorin, brom, yodium dan astatin adalah +1.
Akhirnya, ketika diiradiasi, fluor bereaksi bahkan dengan gas inert (mulia):
Xe + F2 = XeF2 + 152 kJ.
Interaksi fluor dengan zat kompleks juga terjadi dengan sangat kuat. Jadi, ia mengoksidasi air, dan reaksinya bersifat eksplosif:
3F2 + 3H2O = OF2 + 4HF + H2O2.
Klorin bebas juga sangat reaktif, meskipun aktivitasnya lebih kecil dibandingkan aktivitas fluor. Ia bereaksi langsung dengan semua zat sederhana kecuali oksigen, nitrogen dan gas mulia. Sebagai perbandingan, kami menyajikan persamaan reaksi klorin dengan zat sederhana yang sama seperti fluor:
2Al + 3Cl2 = 2AlCl3(cr) + 1405 kJ,
2Fe + 3Cl2 = 2FeCl3(cr) + 804 kJ,
Si + 2Cl2 = SiCl4(L) + 662 kJ,
H2 + Cl2 = 2HCl(g)+185kJ.
Yang menarik adalah reaksi dengan hidrogen. Jadi, pada suhu kamar, tanpa penerangan, klorin praktis tidak bereaksi dengan hidrogen, sedangkan ketika dipanaskan atau disinari (misalnya, secara langsung sinar matahari) reaksi ini berlangsung secara eksplosif menurut mekanisme rantai di bawah ini:
Cl2 + hν → 2Cl,
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl,
Cl + H2 → HCl + H, dst.
Eksitasi reaksi ini terjadi di bawah pengaruh foton (hν), yang menyebabkan disosiasi molekul Cl2 menjadi atom - dalam hal ini, terjadi rantai reaksi yang berurutan, di mana masing-masing partikel muncul, memulai permulaan reaksi berikutnya. panggung.
Reaksi antara H2 dan Cl2 menjadi salah satu objek studi pertama reaksi berantai fotokimia. Kontribusi terbesar bagi pengembangan gagasan tentang reaksi berantai disumbangkan oleh ilmuwan Rusia, pemenang Hadiah Nobel (1956) N. N. Semenov.
Klorin bereaksi dengan banyak zat kompleks, misalnya substitusi dan adisi dengan hidrokarbon:
CH3-CH3 + Cl2 → CH3-CH2Cl + HCl,
CH2=CH2 + Cl2 → CH2Cl - CH2Cl.
Ketika dipanaskan, klor mampu menggantikan brom atau yodium dari senyawanya dengan hidrogen atau logam:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
dan juga bereaksi secara reversibel dengan air:
Cl2 + H2O = HCl + HClO - 25 kJ.
Klorin, yang larut dalam air dan bereaksi sebagian dengannya, seperti ditunjukkan di atas, membentuk campuran kesetimbangan zat yang disebut air klor.
Klorin dapat bereaksi (tidak proporsional) dengan basa dengan cara yang sama:
Cl2 + 2NaOH = NaCl + NaClO + H2O (dalam keadaan dingin),
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (bila dipanaskan).
Aktivitas kimia brom lebih kecil dibandingkan fluor dan klor, tetapi masih cukup tinggi karena brom biasanya digunakan dalam keadaan cair dan oleh karena itu konsentrasi awalnya, jika dianggap sama, lebih besar daripada konsentrasi klor.
Sebagai contoh, kami memberikan reaksi brom dengan silikon dan hidrogen:
Si + 2Br2 = SiBr4(l) + 433 kJ,
H2 + Br2 = 2HBr(g) + 73 kJ.
Yodium berbeda secara signifikan dalam aktivitas kimianya dari halogen lainnya. Ia tidak bereaksi dengan sebagian besar non-logam, dan bereaksi lambat dengan logam hanya jika dipanaskan. Interaksi yodium dengan hidrogen hanya terjadi dengan pemanasan yang kuat; reaksinya bersifat endotermik dan sangat reversibel:
H2 + I2 = 2HI - 53 kJ.
Astatin bahkan kurang reaktif dibandingkan yodium. Tapi ia juga bereaksi dengan logam (misalnya litium):
2Li + At2 = 2LiAt - litium astatida.
Dengan demikian, aktivitas kimia halogen menurun secara berturut-turut dari fluor menjadi astatin. Setiap halogen dalam deret F - At dapat menggantikan halogen berikutnya dari senyawanya dengan hidrogen atau logam.
Seng - unsur dari subkelompok sekunder golongan kedua, periode keempat tabel periodik, dengan nomor atom 30. Seng adalah logam transisi rapuh berwarna putih kebiruan (menodai di udara, ditutupi lapisan tipis seng oksida).
Di alam. Seng tidak terdapat di alam sebagai logam asli. Dari 27 mineral zinc, zinc blende ZnS dan zinc spar ZnCO3 secara praktis penting.
Kuitansi. Seng ditambang dari bijih polimetalik yang mengandung Zn dalam bentuk sulfida. Bijihnya diperkaya, menghasilkan konsentrat seng dan, pada saat yang sama, konsentrat timbal dan tembaga. Konsentrat seng dibakar dalam tungku, mengubah seng sulfida menjadi ZnO oksida:
2ZnS + 3O2 = 2ZnO = 2SO2
Seng murni diperoleh dari ZnO oksida dengan dua cara. Menurut metode pirometalurgi yang telah ada sejak lama, konsentrat yang dikalsinasi disinter untuk memberikan granularitas dan permeabilitas gas, dan kemudian direduksi dengan batu bara atau kokas pada suhu 1200-1300 °C: ZnO + C = Zn + CO.
Metode utama memperoleh seng adalah elektrolitik (hidrometalurgi). Konsentrat yang dipanggang diolah dengan asam sulfat; larutan sulfat yang dihasilkan dibersihkan dari kotoran (dengan mengendapkannya dengan debu seng) dan dilakukan elektrolisis dalam bak yang dilapisi rapat dengan plastik timbal atau vinil. Seng disimpan pada katoda aluminium.
Sifat fisik . DI DALAM bentuk murni- logam putih keperakan yang ulet. Pada suhu kamar seng bersifat rapuh, pada suhu 100-150 °C seng bersifat ulet. Titik lebur = 419.6 °C, titik didih = 906.2 °C.
Sifat kimia. Contoh tipikal pembentukan logam senyawa amfoter. Senyawa seng ZnO dan Zn(OH)2 bersifat amfoter. Potensial elektroda standar adalah −0,76 V, dalam rangkaian potensial standar terletak hingga besi.
Di udara, seng dilapisi dengan lapisan tipis ZnO oksida. Ketika dipanaskan dengan kuat, ia terbakar membentuk oksida putih amfoter ZnO:
Seng oksida bereaksi dengan larutan asam:
dan dengan basa:
Seng dengan kemurnian biasa bereaksi aktif dengan larutan asam:
dan larutan alkali:
membentuk hidroksinat. Seng yang sangat murni tidak bereaksi dengan larutan asam dan basa. Interaksi dimulai ketika beberapa tetes larutan tembaga sulfat CuSO4 ditambahkan.
Ketika dipanaskan, seng bereaksi dengan halogen membentuk halida ZnHal2. Dengan fosfor, seng membentuk fosfida Zn3P2 dan ZnP2. Dengan belerang dan analognya - selenium dan telurium - berbagai kalkogenida, ZnS, ZnSe, ZnSe2 dan ZnTe.
Seng tidak bereaksi langsung dengan hidrogen, nitrogen, karbon, silikon dan boron. Zn3N2 nitrida diperoleh dengan mereaksikan seng dengan amonia pada suhu 550-600 °C.
DI DALAM larutan berair Ion seng Zn2+ membentuk kompleks aqua 2+ dan 2+.