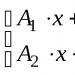Representasi grafis dari hukum periodik adalah Tabel periodik unsur kimia. Lebih dari 700 bentuk tabel periodik diketahui. Menurut keputusan Persatuan Ahli Kimia Internasional, versi semi-panjangnya adalah resmi.
Setiap unsur kimia dalam tabel dialokasikan satu sel, yang berisi simbol dan nama unsur, nomor seri, dan massa atom relatif.
Garis putus-putus menunjukkan batas antara logam dan nonlogam.
Urutan susunan unsur tidak selalu bertepatan dengan pertambahan massa atom. Ada beberapa pengecualian terhadap aturan tersebut. Jadi, massa atom relatif argon lebih kecil dari massa atom kalium, dan telurium lebih kecil dari massa atom yodium.
Setiap elemen memiliki elemennya sendiri urut (atom) nomor , terletak pada periode tertentu dan kelompok tertentu.
Periode adalah rangkaian unsur kimia secara horizontal, dimulai dengan logam alkali (atau hidrogen) dan diakhiri dengan gas inert (mulia).
Di meja tujuh periode. Masing-masing berisi sejumlah elemen tertentu:
\(1\)periode - elemen \(2\),
\(2\)periode - \(8\) elemen,
\(3\)-periode - elemen \(8\),
\(4\)-periode - elemen \(18\),
\(5\)periode - elemen \(18\),
\(6\)periode - elemen \(32\) (\(18 + 14\)),
\(7\)-periode - elemen \(32\) (\(18 + 14\)).
Tiga periode pertama disebut kecil periode, sisanya - besar . Baik dalam periode kecil maupun besar ada yang bertahap melemahnya logam properti dan penguatan non-logam , hanya dalam jangka waktu lama hal itu terjadi lebih lancar.
Elemen dengan nomor seri \(58\)–\(71\) ( lantanida ) dan \(90\)–\(103\) ( aktinida ) dihapus dari tabel dan ditempatkan di bawahnya. Ini adalah unsur golongan IIIB. Lantanida termasuk dalam keenam periode, dan aktinida - hingga ketujuh .
Periode kedelapan akan muncul di Tabel Periodik ketika unsur-unsur baru ditemukan.
Golongan adalah kolom vertikal unsur-unsur kimia yang mempunyai sifat serupa.
Terdapat \(18\) golongan dalam Tabel Periodik, yang diberi nomor dengan angka Arab. Seringkali mereka menggunakan angka Romawi dengan tambahan huruf \(A\) atau \(B\). Dalam kasus ini, grupnya adalah \(8\).
Grup \(A\) memulai dengan unsur periode kecil, juga memasukkan unsur periode besar; mengandung unsur logam dan nonlogam. Dalam versi singkat tabel periodik, memang demikian subgrup utama .
Golongan \(B\) mengandung unsur-unsur dengan periode yang panjang, dan ini hanya logam. Dalam versi singkat tabel periodik, memang demikian subkelompok sekunder .
Jumlah elemen dalam grup:
IA, VIIIA - masing-masing \(7\) elemen;
IIA - VIIA - elemen \(6\);
IIIB - \(32\) elemen (\(4 + 14\) lantanida \(+ 14\) aktinida);
VIIIB - \(12\) elemen;
IB, IIB, IVB - VIIB - masing-masing \(4\) elemen.
Komposisi kuantitatif kelompok akan berubah seiring dengan penambahan elemen baru ke dalam tabel.
Nomor grup Romawi biasanya ditampilkan valensi yang lebih tinggi dalam oksida. Namun untuk beberapa elemen aturan ini tidak berlaku. Jadi, fluor tidak bisa heptavalen, tapi oksigen - heksavalen. Jangan menunjukkan valensi yang sama dengan nomor golongan, helium , neon Dan argon - unsur-unsur ini tidak membentuk senyawa dengan oksigen. Tembaga adalah divalen, dan emas - trivalen, meskipun ini adalah elemen dari kelompok pertama.
Terdiri dari baris vertikal (kelompok) dan baris horizontal (titik). Untuk lebih memahami prinsip penggabungan unsur-unsur ke dalam golongan dan periode, mari kita perhatikan beberapa unsur, misalnya golongan pertama, keempat, dan ketujuh.
Dari konfigurasi elektronik di atas jelas bahwa kulit elektron terluar (energi tertinggi) dari atom-atom dalam golongan yang sama terisi elektron secara merata. Elemen-elemen yang terletak di kolom vertikal yang sama pada tabel termasuk dalam kelompok yang sama. Unsur golongan IVA pada tabel periodik memiliki dua elektron pada orbital s dan dua elektron pada orbital p. Konfigurasi kulit elektron terluar atom fluor F, klor Cl, dan brom Br juga sama (dua elektron s dan lima elektron p). Dan unsur-unsur tersebut termasuk dalam satu golongan (VIIA). Atom-atom unsur dalam satu golongan mempunyai struktur kulit elektron terluar yang sama. Itulah sebabnya unsur-unsur tersebut memiliki sifat kimia yang serupa. Sifat kimia setiap unsur ditentukan oleh struktur elektronik atom unsur tersebut . Ini adalah prinsip dasar kimia modern. Hal inilah yang mendasari tabel periodik.
Nomor golongan tabel periodik sesuai dengan jumlah elektron pada kulit elektron terluar
atom unsur-unsur golongan ini. Nomor periode (baris horizontal tabel periodik) bertepatan dengan jumlah orbital elektron tertinggi yang ditempati. Misalnya, natrium dan klor keduanya merupakan unsur periode ke-3 dan kedua jenis atom tersebut memiliki tingkat pengisian elektron tertinggi - yang ketiga. 
Sebenarnya, jumlah elektron pada kulit elektron terluar menentukan nomor golongan hanya untuk unsur-unsur non-transisi yang terletak dalam golongan dengan indeks huruf A.
Struktur elektronik atom menentukan sifat kimia dan fisik unsur. Dan karena struktur elektronik atom berulang setelah suatu periode, maka sifat-sifat unsur juga berulang secara berkala.
Hukum periodik D. I. Mendeleev memiliki rumusan sebagai berikut: “sifat-sifat unsur kimia, serta bentuk dan sifat zat sederhana serta senyawa yang dibentuknya, secara periodik bergantung pada besarnya muatan inti atomnya”.
Ukuran atom
Kita harus memikirkan dua jenis informasi lagi yang diperoleh dari tabel periodik. Yang pertama adalah pertanyaan tentang ukuran (radius) atom. Jika Anda bergerak ke bawah dalam suatu golongan, berpindah ke setiap unsur berikutnya berarti mengisi elektron pada tingkat berikutnya yang lebih tinggi dan lebih tinggi. Pada golongan IA, elektron terluar atom natrium berada pada orbital 3s, kalium berada pada orbital 4s, rubidium berada pada orbital 5s, dan seterusnya. Karena ukuran orbital 4s lebih besar daripada orbital 3s, maka atom kalium adalah ukurannya lebih besar dari atom natrium. Untuk alasan yang sama di setiap kelompok ukuran atom bertambah dari atas ke bawah .
Saat Anda bergerak ke kanan dalam suatu periode, massa atom bertambah, tetapi ukuran atom cenderung mengecil. Pada periode ke-2, misalnya, atom neon Ne berukuran lebih kecil dari atom fluor, yang selanjutnya lebih kecil dari atom oksigen.

Keelektronegatifan
Kecenderungan lain yang terungkap dalam tabel periodik adalah perubahan alami keelektronegatifan unsur, yaitu kemampuan relatif atom untuk menarik elektron sehingga membentuk ikatan dengan atom lain. Misalnya, atom gas mulia cenderung tidak memperoleh atau kehilangan elektron, sedangkan atom logam mudah melepaskan elektron, dan atom nonlogam mudah menerimanya. Keelektronegatifan (kemampuan menarik, memperoleh elektron) meningkat dari kiri ke kanan dalam satu periode dan dari bawah ke atas dalam satu golongan. Kelompok terakhir (gas inert) berada di luar pola ini.
Fluor F, yang terletak di sudut kanan atas tabel periodik, adalah unsur yang paling elektronegatif, dan fransium Fr, yang terletak di sudut kiri bawah, adalah yang paling elektronegatif. Perubahan keelektronegatifan juga ditunjukkan oleh tanda panah pada gambar.  Dengan menggunakan keteraturan ini, kita dapat, misalnya, berpendapat bahwa oksigen adalah unsur yang lebih elektronegatif dibandingkan karbon atau belerang. Artinya atom oksigen menarik elektron lebih kuat dibandingkan atom karbon dan belerang.
Dengan menggunakan keteraturan ini, kita dapat, misalnya, berpendapat bahwa oksigen adalah unsur yang lebih elektronegatif dibandingkan karbon atau belerang. Artinya atom oksigen menarik elektron lebih kuat dibandingkan atom karbon dan belerang.
Skala elektronegativitas atom relatif Pauling yang pertama dan dikenal luas berkisar dari 0,7 untuk atom fransium hingga 4,0 untuk atom fluor. 
Struktur elektronik gas mulia
 Unsur-unsur golongan terakhir tabel periodik disebut gas inert (mulia). Dalam atom unsur-unsur ini, kecuali helium He, terdapat delapan elektron pada kulit elektron terluar. Gas mulia tidak masuk ke dalam reaksi kimia dan tidak membentuk senyawa apa pun dengan unsur lain (kecuali untuk beberapa pengecualian). Ini karena konfigurasi delapan elektron pada kulit elektron terluar sangat stabil.
Unsur-unsur golongan terakhir tabel periodik disebut gas inert (mulia). Dalam atom unsur-unsur ini, kecuali helium He, terdapat delapan elektron pada kulit elektron terluar. Gas mulia tidak masuk ke dalam reaksi kimia dan tidak membentuk senyawa apa pun dengan unsur lain (kecuali untuk beberapa pengecualian). Ini karena konfigurasi delapan elektron pada kulit elektron terluar sangat stabil.
 Atom unsur lain membentuk ikatan kimia sedemikian rupa sehingga memiliki delapan elektron di kulit terluarnya. Posisi ini sering disebut aturan oktet
.
Atom unsur lain membentuk ikatan kimia sedemikian rupa sehingga memiliki delapan elektron di kulit terluarnya. Posisi ini sering disebut aturan oktet
.
Kuliah No. 2
Tabel periodik unsur kimia D.I. Mendeleev
Rencana:
Penemuan oleh D.I. Hukum Periodik Mendeleev
Prinsip menyusun tabel periodik
Hukum periodik yang dirumuskan oleh D.I. Mendeleev.
Tabel periodik unsur kimia adalah klasifikasi alami unsur kimia, yang merupakan ekspresi grafis (tabel) dari hukum periodik unsur kimia. Strukturnya, dalam banyak hal mirip dengan struktur modern, dikembangkan oleh D. I. Mendeleev berdasarkan hukum periodik pada tahun 1869-1871.
Prototipe sistem periodik adalah " Pengalaman sistem unsur berdasarkan berat atom dan kemiripan kimianya", dikompilasi DI. Mendeleev 1 Maret 1869. Selama dua tahun, ilmuwan terus menyempurnakan “Pengalaman Sistem” dan memperkenalkan konsep golongan, deret, dan periode unsur. Akibatnya, struktur tabel periodik memperoleh bentuk yang sebagian besar modern.
Konsep tempat suatu unsur dalam sistem, yang ditentukan oleh jumlah golongan dan periode, menjadi penting bagi evolusinya. Berdasarkan konsep ini, Mendeleev sampai pada kesimpulan bahwa perlu dilakukan perubahan massa atom beberapa unsur kimia: uranium, indium, cerium, dan satelitnya. Ini adalah penerapan praktis pertama dari tabel periodik. Mendeleev juga meramalkan keberadaan beberapa unsur yang belum diketahui untuk pertama kalinya. Ilmuwan menjelaskan sifat terpenting dari eka-aluminium (masa depan galium), eka-boron (skandium) dan eka-silikon (germanium). Selain itu, ia meramalkan adanya analog mangan (teknesium dan renium masa depan), telurium (polonium), yodium (astatin), cesium (Prancis), barium (radium), tantalum (protaktinium). Prediksi ilmuwan mengenai unsur-unsur ini bersifat umum, karena unsur-unsur ini terletak di wilayah yang jarang dipelajari dalam tabel periodik.
Versi pertama dari sistem periodik unsur kimia sebagian besar hanya mewakili generalisasi empiris. Bagaimanapun, makna fisika dari hukum periodik tidak jelas; tidak ada penjelasan tentang alasan perubahan periodik sifat-sifat unsur tergantung pada peningkatan massa atom. Dalam hal ini, masih banyak permasalahan yang belum terselesaikan. Apakah ada batasan dalam tabel periodik? Apakah mungkin untuk menentukan jumlah pasti unsur-unsur yang ada? Yang masih belum jelas adalah struktur periode keenam - berapa jumlah pasti unsur tanah jarang. Tidak diketahui apakah unsur antara hidrogen dan litium masih ada, dan bagaimana struktur periode pertama. Oleh karena itu, hingga pembuktian fisik hukum periodik dan perkembangan teori sistem periodik, kesulitan serius muncul lebih dari satu kali. Penemuan pada tahun 1894 – 1898 sungguh tidak terduga. galaksi gas inert, yang tampaknya tidak memiliki tempat dalam tabel periodik. Kesulitan ini dihilangkan berkat gagasan untuk memasukkan kelompok nol independen ke dalam struktur tabel periodik. Penemuan massal unsur radio pada pergantian abad ke-19 dan ke-20. (pada tahun 1910 jumlahnya sekitar 40) menyebabkan kontradiksi yang tajam antara kebutuhan untuk menempatkan mereka dalam tabel periodik dan struktur yang ada. Hanya ada 7 lowongan bagi mereka pada periode keenam dan ketujuh. Masalah ini diselesaikan dengan penetapan aturan pergeseran dan penemuan isotop.
Salah satu alasan utama ketidakmungkinan menjelaskan makna fisika hukum periodik dan struktur sistem periodik adalah tidak diketahuinya bagaimana atom terbentuk (lihat Atom). Tonggak terpenting dalam perkembangan tabel periodik adalah penciptaan model atom oleh E. Rutherford (1911). Atas dasar itu, ilmuwan Belanda A. Van den Broek (1913) mengemukakan bahwa nomor urut suatu unsur dalam tabel periodik secara numerik sama dengan muatan inti atomnya (Z). Hal ini secara eksperimental dikonfirmasi oleh ilmuwan Inggris G. Moseley (1913). Hukum periodik mendapat pembenaran fisik: periodisitas perubahan sifat-sifat unsur mulai dipertimbangkan bergantung pada muatan Z inti atom unsur, dan bukan pada massa atom.
Hasilnya, struktur sistem periodik Mendeleev diperkuat secara signifikan. Batas bawah sistem telah ditentukan. Ini adalah hidrogen - unsur dengan minimum Z = 1. Jumlah unsur antara hidrogen dan uranium dapat diperkirakan secara akurat. “Kesenjangan” dalam tabel periodik diidentifikasi, sesuai dengan unsur-unsur yang tidak diketahui dengan Z = 43, 61, 72, 75, 85, 87. Namun, pertanyaan tentang jumlah pasti unsur tanah jarang masih belum jelas dan, yang paling penting, alasan untuk periodisitas perubahan sifat-sifat unsur tidak terungkap tergantung pada Z.
Berdasarkan struktur sistem periodik yang ada dan hasil kajian spektrum atom, ilmuwan DenmarkN.Bor pada tahun 1918 - 1921gg. mengembangkan gagasan tentang urutan konstruksi kulit elektron dan subkulit dalam atom. Ilmuwan sampai pada kesimpulan bahwa jenis konfigurasi elektronik atom yang serupa berulang secara berkala. Dengan demikian, terlihat bahwa periodisitas perubahan sifat-sifat unsur kimia dijelaskan oleh adanya periodisitas konstruksi kulit elektron dan subkulit atom.
Saat ini, tabel periodik mencakup 117 unsur.Dari jumlah tersebut, semua unsur transuranium (Z" = 93 - 117), serta unsur dengan Z = 43 (teknesium), 61 (prometium), 85 (astatin), 87 (fransium) diperoleh secara buatan. adanya sistem periodik, diusulkan sejumlah besar (> 500) pilihan representasi grafisnya, terutama dalam bentuk tabel, serta dalam bentuk berbagai bentuk geometris (spasial dan planar), kurva analitis (spiral , dll.), dll. Yang paling luas adalah bentuk tabel periodik pendek, panjang dan berundak. Saat ini, preferensi diberikan pada yang pendek.
Prinsip dasar konstruksi tabel periodik adalah nyapembagian menjadi kelompok dan periode.Konsep deret unsur Mendeleev tidak digunakan saat ini karena tidak memiliki makna fisik.Kelompok-kelompok tersebut, pada gilirannya, dibagi menjadi subkelompok utama (a) dan sekunder (b).Setiap subkelompok mengandung unsur - analog kimia. Unsur-unsur subgrup a dan b pada sebagian besar golongan juga menunjukkan kemiripan tertentu satu sama lain, terutama pada bilangan oksidasi yang lebih tinggi, yang biasanya sama dengan nomor golongan.
Periode adalah kumpulan unsur-unsur yang dimulai dengan logam alkali dan diakhiri dengan gas inert (kasus khusus adalah periode pertama).Setiap periode mengandung sejumlah elemen yang ditentukan secara ketat. Tabel periodik terdiri dari delapan golongan dan tujuh periode, dengan periode ketujuh belum selesai.
Keunikan periode pertama adalahdalam apa yang dikandungnyahanya 2 elemen: hidrogen dan helium. Tempat hidrogen dalam sistem ini masih ambigu. Karena ia menunjukkan sifat yang sama dengan logam alkali dan halogen, ia ditempatkan dalam subgrup I A atau VII A, pilihan terakhir lebih sering digunakan. Helium adalah perwakilan pertama dari subkelompok VIII A. Untuk waktu yang lama, helium dan semua gas inert dipisahkan menjadi kelompok nol yang independen. Ketentuan ini memerlukan revisi setelah sintesis senyawa kimia kripton, xenon dan radon. Akibatnya, gas mulia dan unsur-unsur golongan VIII sebelumnya (logam besi, kobalt, nikel, dan platina) digabungkan dalam satu golongan. Pilihan ini bukannya tanpa cela, karena kelembaman helium dan neon tidak diragukan lagi.
Periode kedua berisi 8 unsur.Dimulai dengan litium logam alkali, yang bilangan oksidasinya hanya +1. Berikutnya adalah berilium (logam yang bilangan oksidasinya +2). Boron sudah menunjukkan karakter logam yang lemah dan merupakan non-logam (bilangan oksidasi + 3). Selain boron, karbon adalah nonlogam yang khas, menunjukkan bilangan oksidasi +4 dan -4. Nitrogen, oksigen, fluor, dan neon semuanya bukan logam, dengan nitrogen memiliki bilangan oksidasi tertinggi +5 sesuai dengan nomor golongannya; untuk fluor, bilangan oksidasinya diketahui + 7. Gas neon inert melengkapi periodenya.
Periode ketiga (natrium - argon) juga mengandung 8 unsur. Sifat perubahan sifat-sifatnya sebagian besar mirip dengan yang diamati pada unsur-unsur periode kedua. Namun ada juga beberapa kekhususan di sini. Jadi, magnesium, tidak seperti berilium, lebih bersifat logam, seperti halnya aluminium dibandingkan dengan boron. Silikon, fosfor, belerang, klor, argon semuanya merupakan unsur non-logam. Dan semuanya, kecuali argon, menunjukkan bilangan oksidasi yang lebih tinggi, sama dengan nomor golongannya.
Seperti yang bisa kita lihat, pada kedua periode, dengan meningkatnya Z, terjadi pelemahan sifat logam dan peningkatan sifat non-logam unsur-unsur.D. I. Mendeleev menyebut unsur kedua dan ketigaperiode (dalam kata-katanya, kecil) khas.Unsur-unsur periode kecil termasuk yang paling umum di alam. Karbon, nitrogen dan oksigen (bersama dengan hidrogen) adalah organogen, mis. unsur dasar bahan organik.
Semua elemen periode pertama - ketiga ditempatkan dalam subgrup A.
Periode keempat (kalium - kripton) mengandung 18 unsur.Menurut Mendeleev, ini adalah periode besar pertama. Setelah logam alkali kalium dan kalsium logam alkali tanah muncul serangkaian unsur yang terdiri dari 10 logam transisi (skandium - seng). Semuanya termasuk dalam subgrup b. Kebanyakan logam transisi menunjukkan bilangan oksidasi lebih tinggi yang sama dengan nomor golongannya, kecuali besi, kobalt, dan nikel. Unsur-unsurnya, dari galium hingga kripton, termasuk dalam subkelompok A. Krypton, tidak seperti gas mulia sebelumnya, dapat membentuk senyawa kimia.
Periode kelima (rubidium - xenon) memiliki struktur yang mirip dengan periode keempat. Ini juga berisi sisipan 10 logam transisi (yttrium - kadmium). Unsur-unsur masa ini mempunyai ciri khas tersendiri. Dalam triad rutenium - rhodium - paladium, senyawa rutenium diketahui memiliki bilangan oksidasi +8. Semua unsur subgrup A menunjukkan bilangan oksidasi yang lebih tinggi sama dengan nomor golongannya, kecuali xenon. Terlihat bahwa ciri-ciri perubahan sifat-sifat unsur periode keempat dan kelima seiring bertambahnya Z lebih kompleks dibandingkan dengan periode kedua dan ketiga.
Periode keenam (cesium - radon) mencakup 32 unsur.Periode ini, selain 10 logam transisi (lantanum, hafnium - merkuri), juga mengandung 14 lantanida - dari cerium hingga lutetium. Unsur-unsur dari serium hingga lutetium secara kimiawi sangat mirip, dan oleh karena itu unsur-unsur tersebut telah lama dimasukkan dalam keluarga unsur tanah jarang. Dalam tabel periodik bentuk singkat, sejumlah spesies lantanum termasuk dalam sel lantanum dan penguraian deret ini diberikan di bagian bawah tabel.
Apa kekhususan unsur periode keenam? Dalam triad osmium - iridium - platinum, bilangan oksidasi +8 dikenal untuk osmium. Astatin memiliki karakter metalik yang cukup menonjol. Radon mungkin merupakan gas mulia yang paling reaktif. Sayangnya, karena kandungan radioaktifnya yang tinggi, sifat kimianya masih sedikit dipelajari).
Periode ketujuh dimulai dengan Perancis.Seperti yang keenam, seharusnya juga mengandung 32 unsur, tetapi 21 di antaranya masih diketahui. Fransium dan radium, masing-masing, merupakan unsur dari subkelompok I a dan I I a, aktinium termasuk dalam subkelompok III b. Pembangunan lebih lanjut dari periode ketujuh masih kontroversial. Pandangan yang paling umum adalah dari keluarga aktinida, yang mencakup unsur-unsur dari thorium hingga lawrensium dan mirip dengan lantanida. Penguraian rangkaian elemen ini juga diberikan di bagian bawah tabel.
Bagaimana sifat-sifat unsur kimia berubah pada subkelompok tabel periodik Mendeleev?
Pola utama perubahan ini adalah menguatnya sifat logam unsur-unsur seiring bertambahnya Z. Pola ini terutama terlihat jelas pada subkelompok IIIa-VIIa. Untuk logam subkelompok I A-III A, terjadi peningkatan aktivitas kimia. Untuk unsur-unsur subkelompok IVA - VIIA, dengan meningkatnya Z, terjadi pelemahan aktivitas kimia unsur-unsur tersebut. Untuk unsur subgrup b, perubahan aktivitas kimianya lebih kompleks.
Teori sistem periodik dikembangkan oleh N. Bohr dan ilmuwan lainnya pada tahun 20-an.abad XX dan didasarkan pada skema nyata pembentukan konfigurasi elektronik atom. Menurut teori ini, dengan bertambahnya Z, pengisian kulit elektron dan subkulit pada atom unsur-unsur yang termasuk dalam periode tabel periodik terjadi dengan urutan sebagai berikut:
Nomor periode
1 2 3 4 5 6 7
1s2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p7s5f6d7p
Berdasarkan teori sistem periodik, dapat diberikan pengertian periode sebagai berikut:suatu periode adalah kumpulan unsur-unsur yang diawali dengan unsur yang bernilai n. sama dengan nomor periode, dan l=0 (elemen s) dan diakhiri dengan elemen dengan nilai yang sama n dan l = 1 (elemen p). Pengecualiannya adalah periode pertama, yang hanya mengandung unsur 1s. Dari teori sistem periodik, banyaknya unsur dalam periode sebagai berikut: 2, 8, 8. 18, 18, 32...
Subgrup b mencakup unsur-unsur yang atomnya mengalami penyelesaian cangkang yang sebelumnya tidak lengkap. Oleh karena itu periode pertama, kedua dan ketiga tidak mengandung unsur subgrup b.
Struktur tabel periodik unsur kimia erat kaitannya dengan struktur atom unsur kimia. Dengan bertambahnya Z, jenis konfigurasi kulit elektron terluar yang serupa berulang secara berkala. Yaitu, mereka menentukan ciri-ciri utama perilaku kimia unsur. Ciri-ciri ini memanifestasikan dirinya secara berbeda untuk elemen subgrup A (elemen s dan p), untuk elemen subgrup b (elemen d transisi) dan elemen keluarga f - lantanida dan aktinida. Kasus khusus diwakili oleh unsur-unsur periode pertama - hidrogen dan helium. Hidrogen sangat reaktif karena elektron b tunggalnya mudah dihilangkan. Pada saat yang sama, konfigurasi helium (1) sangat stabil, yang menentukan ketidakaktifan kimianya sepenuhnya.
Untuk unsur-unsur subkelompok A, kulit elektron terluar terisi (dengan n sama dengan nomor periode); oleh karena itu, sifat-sifat unsur-unsur ini berubah secara nyata seiring dengan bertambahnya Z. Jadi, pada periode kedua, litium (konfigurasi 2s) adalah logam aktif yang dengan mudah kehilangan satu-satunya elektron valensinya; berilium (2s~) juga merupakan logam, tetapi kurang aktif karena elektron terluarnya terikat lebih erat pada inti. Lebih lanjut, boron (23"p) memiliki karakter logam yang lemah, dan semua unsur berikutnya pada periode kedua, yang memiliki subkulit 2p, sudah merupakan non-logam. Konfigurasi delapan elektron pada kulit elektron terluar neon (2s~p~) - gas inert - sangat tahan lama.
Sifat kimia unsur periode kedua dijelaskan oleh keinginan atomnya untuk memperoleh konfigurasi elektronik gas inert terdekat (konfigurasi helium untuk unsur dari litium hingga karbon atau konfigurasi neon untuk unsur dari karbon hingga fluor). Inilah sebabnya, misalnya, oksigen tidak dapat menunjukkan bilangan oksidasi lebih tinggi yang sama dengan nomor golongannya: oksigen lebih mudah mencapai konfigurasi neon dengan memperoleh elektron tambahan. Sifat perubahan sifat yang sama diwujudkan dalam unsur-unsur periode ketiga dan dalam unsur-unsur s dan p dari semua periode berikutnya. Pada saat yang sama, melemahnya kekuatan ikatan antara elektron terluar dan inti pada subgrup A seiring dengan peningkatan Z dimanifestasikan dalam sifat-sifat unsur yang bersesuaian. Jadi, untuk unsur s terdapat peningkatan aktivitas kimia yang nyata seiring dengan peningkatan Z, dan untuk unsur p terdapat peningkatan sifat logam.
Pada atom-atom unsur transisi d, kulit yang sebelumnya tidak lengkap dengan nilai bilangan kuantum utama dan satu kurang dari bilangan periode diselesaikan. Dengan beberapa pengecualian, konfigurasi kulit elektron terluar atom unsur transisi adalah ns. Oleh karena itu, semua unsur d adalah logam, dan inilah sebabnya perubahan sifat unsur 1 seiring bertambahnya Z tidak sedramatis yang kita lihat pada unsur s dan p. Pada bilangan oksidasi yang lebih tinggi, unsur d menunjukkan kemiripan tertentu dengan unsur p dari golongan yang bersesuaian pada tabel periodik.
Keunikan sifat-sifat unsur triad (subgrup VIII b) dijelaskan oleh fakta bahwa subkulit d hampir selesai. Inilah sebabnya mengapa logam besi, kobalt, nikel, dan platinum cenderung tidak menghasilkan senyawa dengan bilangan oksidasi lebih tinggi. Satu-satunya pengecualian adalah rutenium dan osmium, yang menghasilkan oksida RuO4 dan OsO4. Untuk unsur subgrup I dan II B, subkulit d sebenarnya sudah lengkap. Oleh karena itu, mereka menunjukkan bilangan oksidasi yang sama dengan nomor golongannya.
Dalam atom lantanida dan aktinida (semuanya adalah logam)penyelesaian kulit elektron yang sebelumnya tidak lengkap terjadi dengan nilai bilangan kuantum utama dan dua satuan lebih kecil dari bilangan periode. Pada atom unsur-unsur ini, konfigurasi kulit elektron terluar (ns2) tetap tidak berubah. Pada saat yang sama, elektron f sebenarnya tidak berpengaruh pada sifat kimia. Inilah sebabnya mengapa lantanida sangat mirip.
Untuk aktinida, situasinya jauh lebih rumit.Pada kisaran muatan inti Z = 90 - 95, elektron bd dan 5/ dapat mengambil bagian dalam interaksi kimia. Oleh karena itu, aktinida menunjukkan kisaran bilangan oksidasi yang jauh lebih luas. Misalnya, untuk neptunium, plutonium, dan amerisium, diketahui senyawa yang unsur-unsurnya muncul dalam keadaan tujuh valensi. Hanya untuk unsur yang dimulai dengan curium (Z = 96) keadaan trivalennya menjadi stabil. Dengan demikian, sifat-sifat aktinida berbeda secara signifikan dari sifat-sifat lantanida, dan oleh karena itu kedua famili tersebut tidak dapat dianggap serupa.
Keluarga aktinida diakhiri dengan unsur dengan Z = 103 (lawrencium). Penilaian sifat kimia kurchatovium (Z = 104) dan nilsborium (Z = 105) menunjukkan bahwa unsur-unsur ini masing-masing harus analog dengan hafnium dan tantalum. Oleh karena itu, para ilmuwan percaya bahwa setelah keluarga aktinida dalam atom, pengisian subkulit 6d secara sistematis dimulai.
Jumlah akhir unsur yang tercakup dalam tabel periodik tidak diketahui. Masalah batas atasnya mungkin merupakan misteri utama tabel periodik. Unsur terberat yang ditemukan di alam adalah plutonium (Z = 94). Batas fusi nuklir buatan telah tercapai - suatu unsur dengan nomor atom 107. Pertanyaannya tetap terbuka: apakah mungkin memperoleh unsur dengan nomor atom besar, yang mana dan berapa banyak? Hal ini belum bisa dijawab secara pasti.
Dengan menggunakan perhitungan rumit yang dilakukan di komputer, para ilmuwan mencoba menentukan struktur atom dan mengevaluasi sifat-sifat terpenting dari “elemen super” tersebut, hingga nomor seri yang sangat besar (Z = 172 dan bahkan Z = 184). Hasil yang didapat cukup di luar dugaan. Misalnya, dalam atom suatu unsur dengan Z = 121, elektron 8p diharapkan muncul; ini terjadi setelah pembentukan subkulit 8s selesai pada atom dengan Z = 119 dan 120. Tetapi kemunculan elektron p setelah elektron s hanya diamati pada atom unsur periode kedua dan ketiga. Perhitungan juga menunjukkan bahwa untuk unsur-unsur periode kedelapan hipotetis, pengisian kulit elektron dan subkulit atom terjadi dalam urutan yang sangat kompleks dan unik. Oleh karena itu, menilai sifat-sifat unsur-unsur yang bersesuaian adalah masalah yang sangat sulit. Tampaknya periode kedelapan harus mengandung 50 unsur (Z = 119 - 168), tetapi menurut perhitungan, harus diakhiri pada unsur dengan Z = 164, yaitu. 4 nomor seri tadi. Dan periode kesembilan yang “eksotis” ternyata terdiri dari 8 unsur. Ini entri "elektronik" nya: 9s "Зр 9р". Dengan kata lain hanya memuat 8 unsur saja, seperti periode kedua dan ketiga.
Sulit untuk mengatakan seberapa benar perhitungan yang dilakukan dengan menggunakan komputer. Namun, jika hal tersebut terkonfirmasi, maka perlu mempertimbangkan kembali secara serius pola yang mendasari tabel periodik unsur dan strukturnya.
Tabel periodik telah memainkan dan terus memainkan peran besar dalam pengembangan berbagai bidang ilmu pengetahuan alam.Ini adalah pencapaian paling penting dalam ilmu atom-molekul, yang berkontribusi pada munculnya konsep modern tentang "unsur kimia" dan klarifikasi konsep tentang zat dan senyawa sederhana.
Pola yang diungkapkan oleh sistem periodikmempunyai pengaruh yang signifikan terhadap perkembangan teori struktur atom, penemuan isotop, dan munculnya gagasan tentang periodisitas nuklir. Sistem periodik dikaitkan dengan rumusan ilmiah yang ketat tentang masalah peramalan dalam kimia. Hal ini diwujudkan dalam prediksi keberadaan dan sifat unsur-unsur yang belum diketahui serta ciri-ciri baru perilaku kimia unsur-unsur yang telah ditemukan. Saat ini, tabel periodik mewakili dasar-dasar kimia, terutama anorganik, yang secara signifikan membantu memecahkan masalah sintesis kimia zat dengan sifat yang telah ditentukan, pengembangan bahan semikonduktor baru, pemilihan katalis spesifik untuk berbagai proses kimia, dll. Terakhir, tabel periodik mendasari pengajaran kimia.
Hukum periodik Mendeleev
Hukum periodik unsur kimia adalah hukum dasar alam, yang mencerminkan perubahan periodik sifat-sifat unsur kimia seiring dengan meningkatnya muatan inti atomnya. Dibuka pada 1 Maret (17 Februari, Gaya Lama) 1869 D.I. Mendeleev. Pada hari ini, dia menyusun tabel yang disebut “Pengalaman sistem unsur berdasarkan berat atom dan kesamaan kimianya.” Rumusan akhir hukum periodik diberikan oleh Mendeleev pada bulan Juli 1871. Bunyinya:
« Sifat-sifat unsur, dan oleh karena itu sifat benda sederhana dan kompleks yang dibentuknya, secara periodik bergantung pada berat atomnya.”
Rumusan hukum periodik Mendeleev telah ada dalam sains selama lebih dari 40 tahun. Itu direvisi karena pencapaian luar biasa dalam fisika, terutama pengembangan model nuklir atom. Ternyata,muatan inti atom (Z) secara numerik samanomor seriunsur yang bersesuaian dalam tabel periodik, dan pengisian kulit elektron dan subkulit atom, bergantung pada Z, terjadi sedemikian rupa sehingga konfigurasi elektronik atom yang serupa berulang secara berkala (lihat Tabel Periodik Unsur Kimia). Oleh karena itu, rumusan hukum periodik modern adalah sebagai berikut:sifat-sifat unsur, zat sederhana, dan senyawanya secara periodik bergantung pada muatan inti atom.
Berbeda dengan hukum dasar alam lainnya, seperti hukum gravitasi universal atau hukum kesetaraan massa dan energi, hukum periodik tidak dapat ditulis dalam bentuk persamaan atau rumus umum apa pun. Refleksi visualnya adalah tabel periodik unsur. Namun, Mendeleev sendiri dan ilmuwan lain berupaya menemukan persamaan matematika untuk hukum periodik unsur kimia. Upaya ini berhasil hanya setelah berkembangnya teori struktur atom. Tetapi hal ini hanya menyangkut penetapan ketergantungan kuantitatif urutan distribusi elektron pada kulit dan subkulit pada muatan inti atom.
Hukum periodik merupakan hukum universal yang berlaku di seluruh alam semesta.Ia memiliki kekuatan dimanapun atom berada. Namun tidak hanya struktur elektronik atom yang berubah secara berkala. Struktur dan sifat inti atom juga mematuhi hukum periodik yang khas. Dalam inti yang terdiri dari neutron dan proton, terdapat cangkang neutron dan proton yang pengisiannya bersifat periodik. Bahkan ada upaya yang diketahui untuk membangun sistem periodik inti atom.
Dmitry Ivanovich Mendeleev (1834 - 1907)
Ilmuwan Rusia menemukan hukum periodik unsur kimia.
Pada tahun 1955 orang Amerikafisikawan yang dipimpin oleh G. Seaborg mensintesis unsur kimia dengan nomor atom101. Mereka memberinya namamendelevium- sebagai pengakuan atas jasa ilmuwan besar Rusia.Tabel periodik Mendeleev telah menjadi kunci penemuan unsur baru selama lebih dari 100 tahun.
Hukum periodik dan sistem periodik menjadi kontribusi terpenting D. I. Mendeleev bagi perkembangan ilmu pengetahuan alam. Namun hal-hal tersebut hanyalah sebagian dari warisan kreatif ilmuwan yang sangat besar.Koleksi lengkap karyanya - 25 jilid, ensiklopedia pengetahuan yang nyata.
Mendeleev memasukkan informasi yang tersebar ke dalam sistem tentang isomorfisme, dan ini berperan dalam pengembangan geokimia. Ia menemukan titik didih kritis, yang di atasnya suatu zat tidak dapat berada dalam wujud cair, mengembangkan teori hidrasi larutan, dan dengan demikian dianggap sebagai ahli kimia fisika terkemuka. Dia melakukan studi mendalam tentang sifat-sifat gas yang dijernihkan, menunjukkan dirinya sebagai fisikawan eksperimental yang luar biasa. Mendeleev mengajukan teori asal muasal minyak anorganik, yang masih memiliki penganut; mengembangkan proses pembuatan bubuk mesiu tanpa asap; mempelajari aeronautika, meteorologi, meningkatkan teknik pengukuran. Sebagai pengelola Kamar Utama Berat dan Ukuran, ia banyak berbuat untuk pengembangan metrologi. Atas jasa ilmiahnya, Mendeleev terpilih menjadi anggota lebih dari 50 akademi dan perkumpulan ilmiah di seluruh dunia. Dalam aktivitas ilmiahnya, sang ilmuwan, dalam kata-katanya, melihat “pengabdian pertamanya kepada Tanah Air”.
Pelayanan yang kedua adalah mengajar. Mendeleev adalah penulis buku teks “Fundamentals of Chemistry,” yang telah melewati 8 edisi selama hidupnya dan diterjemahkan ke dalam bahasa asing lebih dari satu kali. Mendeleev mengajar di banyak institusi pendidikan di St. “Dari ribuan murid saya, banyak yang kini menjadi tokoh terkemuka di mana pun, dan ketika saya bertemu mereka, saya selalu mendengar bahwa saya mempercayai benih baik dalam diri mereka, dan tidak sekadar menjalankan tugas,” tulis ilmuwan tersebut di tahun-tahun kemundurannya.
“Layanan ketiga ke Tanah Air” memiliki banyak segi dan berguna - di bidang industri dan pertanian. Di sini Mendeleev menunjukkan dirinya sebagai seorang patriot sejati yang peduli terhadap perkembangan dan masa depan Rusia. Di perkebunan Boblovo miliknya, dia melakukan “eksperimen dalam pemuliaan biji-bijian”. Dia mempelajari secara rinci metode produksi minyak dan memberikan banyak rekomendasi berharga untuk perbaikannya. Dia terus-menerus menyelidiki kebutuhan mendesak industri, mengunjungi pabrik dan pabrik, pertambangan dan pertambangan. Kewibawaan Mendeleev begitu tinggi sehingga ia terus-menerus diundang sebagai ahli untuk memecahkan masalah ekonomi yang kompleks. Sesaat sebelum kematiannya, ia menerbitkan buku “Menuju Pengetahuan Rusia,” di mana ia menguraikan program ekstensif untuk pengembangan kekuatan produktif negara tersebut.
“Penaburan ilmiah akan bertunas untuk panen masyarakat” - Ini adalah motto dari semua aktivitas ilmuwan.
Mendeleev adalah salah satu orang paling berbudaya pada masanya. Dia sangat tertarik pada sastra dan seni, dan mengumpulkan banyak koleksi reproduksi lukisan karya seniman dari berbagai negara dan masyarakat. Pertemuan tokoh budaya terkemuka kerap terjadi di apartemennya.
Pertanyaan keamanan:
Pada tahun berapa hukum periodik unsur kimia ditemukan, yang dirumuskan oleh D. I. Mendeleev?
Apa inti dari hukum periodisitas? Apa saja fitur utamanya?
Apa yang dimaksud dengan periode, golongan, subkelompok dalam tabel periodik?
Subkelompok manakah yang disebut utama dan mana yang sekunder?
Bagaimana sifat logam suatu unsur berubah dalam satu golongan dan dalam satu periode?
Bagaimana sifat redoks atom unsur berubah seiring bertambahnya nomor atom?
Golongan tabel periodik manakah yang mengandung unsur-unsur yang membentuk senyawa gas dengan hidrogen? Manakah yang bersifat asam?
Jika Anda menggambar garis pada tabel periodik dari boron ke astatin, maka unsur dengan sifat apa yang berada di sisi kiri garis tersebut?
Apa inti dari teori mekanika kuantum struktur atom?
Berikan rumusan modern dari hukum periodik D.I.
Temukan dalam tabel periodik suatu unsur yang terletak pada periode IV, pada baris V dan menunjukkan valensi VI dalam senyawa oksigen. Berapa valensi hidrogennya?
Literatur:
Gabrielyan O, S. Kimia untuk profesi dan spesialisasi teknis: buku teks / O.S. Gabrielyan, I.G. Ostroumov. – M.: Pusat Penerbitan “Akademi”, 2009. – 256 hal.
Gabrielyan O, S. Kimia: buku teks untuk siswa. rata-rata Prof. buku pelajaran perusahaan/ O.S. Gabrielyan, I.G. Ostroumov. – Edisi ke-6, terhapus. – M.: Pusat Penerbitan “Akademi”, 2009. – 336 hal.
SISTEM PERIODIK, satu set bahan kimia yang dipesan. elemen, sifatnya. , yang merupakan ekspresi tabel. Prototipe periodik sistem kimia unsur didasarkan pada tabel “Pengalaman sistem unsur berdasarkan kesamaan kimianya”, yang disusun oleh D. I. Mendeleev pada tanggal 1 Maret 1869 (Gbr. 1). Akhirnya Selama bertahun-tahun, ilmuwan memperbaiki tabel, mengembangkan gagasan tentang periode dan kelompok unsur serta tempat suatu unsur dalam sistem. Pada tahun 1870, Mendeleev menyebut sistem itu alami, dan pada tahun 1871 periodik. Akibatnya, sistem periodik dalam banyak hal memperoleh bentuk modernnya.
garis besar struktural. Berdasarkan hal tersebut, Mendeleev meramalkan keberadaan orang suci ca. 10 elemen yang tidak diketahui; prediksi ini kemudian dikonfirmasi.
Namun, selama lebih dari 40 tahun ke depan, tabel periodik akan berubah. gelar hanya empiris. generalisasi fakta, karena tidak ada fisik penjelasan alasan secara berkala. perubahan elemen CB-B tergantung pada peningkatannya. Penjelasan seperti itu tidak mungkin terjadi tanpa gagasan yang beralasan tentang strukturnya (lihat).
Oleh karena itu, tonggak terpenting dalam perkembangan tabel periodik adalah model planet (nuklir) yang dikemukakan oleh E. Rutherford (1911). Pada tahun 1913, A. van den Broek sampai pada kesimpulan bahwa suatu unsur dalam tabel periodik secara numerik sama dengan posi. muatan (Z) dari intinya. Kesimpulan ini secara eksperimental dikonfirmasi oleh G. Moseley (hukum Moseley, 1913-14). Alhasil, berkala hukum menerima fisik yang ketat formulasi, adalah mungkin untuk secara jelas menentukan hal-hal berikut. batas tabel periodik (H sebagai unsur dengan minimum Z=1), perkirakan jumlah pasti unsur antara H dan U dan tentukan unsur mana yang belum ditemukan (Z = 43, 61, 72, 75, 85 , 87). Teori tabel periodik dikembangkan pada awalnya. tahun 1920-an (lihat di bawah). Struktur tabel periodik.
Sepanjang sejarah tabel periodik, lebih dari 500 versi berbeda dari gambarnya telah diterbitkan. Hal ini disebabkan oleh upaya untuk menemukan solusi rasional terhadap masalah kontroversial tertentu dalam struktur tabel periodik (penempatan H, lantanida, dll.). Naib.
tersebar sebagai berikut. bentuk tabel ekspresi sistem periodik: 1) yang pendek diusulkan oleh Mendeleev (dalam bentuknya yang sekarang ditempatkan di awal volume pada daun berwarna);
Golongan VIII menempati tempat khusus dalam struktur tabel periodik. Untuk waktu yang lama waktu, hanya elemen “triad” yang dikaitkan dengannya: Fe-Co-Ni dan (Ru Rh Pd dan Os-Ir-Pt), dan semuanya ditempatkan pada posisi independen. kelompok nol; oleh karena itu, tabel periodik berisi 9 golongan. Setelah di tahun 60an. diterima samb. Xe, Kr dan Rn mulai ditempatkan pada subgrup VIIIa, dan grup nol dihapuskan.
Unsur-unsur triad membentuk subkelompok VIII6. “Rancangan struktural” golongan VIII ini sekarang muncul di hampir semua ekspresi tabel periodik yang diterbitkan.

Akan membedakan. Ciri periode pertama hanya mengandung 2 unsur yaitu H dan He. karena yang suci - kesatuan. suatu unsur yang tidak mempunyai tempat yang jelas dalam tabel periodik. Simbol H ditempatkan di subgrup Ia, atau di subgrup VIIa, atau di keduanya sekaligus, mengapit simbol dalam tanda kurung di salah satu subgrup, atau, terakhir, menggambarkannya sebagai terpisah. font. Cara menyusun H ini didasarkan pada fakta bahwa ia mempunyai persamaan formal tertentu dengan keduanya.
Beras. 2. Periodik bentuk panjang.
sistem kimia elemen (versi modern). Beras. 3. Bentuk tangga periodik. sistem kimia elemen (H., 1921).Periode kedua (Li-Ne), mengandung 8 unsur, diawali dengan Li (kesatuan, + 1); diikuti oleh Menjadi(+2). Metalik karakter B (+3) diekspresikan dengan lemah, dan karakter berikutnya, C, tipikal (+4). Berikut ini adalah N, O, F dan Ne-non-logam, dengan hanya N yang memiliki + 5 tertinggi sesuai dengan nomor golongannya; O dan F termasuk yang paling aktif.
Periode ketiga (Na-Ar) juga mencakup 8 unsur, sifat perubahan kimianya. St. yang dalam banyak hal mirip dengan yang diamati pada periode kedua. Namun, Mg dan Al lebih bersifat “logam” dibandingkan dengan keduanya. Be dan B. Unsur sisanya adalah Si, P, S, Cl dan Ar bukan logam; semuanya menunjukkan , sama dengan nomor golongannya, kecuali Ar. T.
Periode keempat (K-Kr) mengandung 18 unsur. Setelah K dan alkali tanah. Ca (s-elemen) mengikuti rangkaian 10 yang disebut. transisi (Sc-Zn), atau elemen d (simbol biru), yang termasuk dalam subgrup b. Mayoritas (semuanya - ) menunjukkan lebih tinggi, sama dengan nomor golongan, tidak termasuk triad Fe-Co-Ni, di mana Fe dalam kondisi tertentu memiliki +6, dan Co dan Ni adalah trivalen maksimal. Unsur-unsur dari Ga ke Kr termasuk dalam subkelompok a (unsur-p), dan sifat perubahan sifat-sifatnya dalam banyak hal mirip dengan perubahan sifat-sifat unsur periode kedua dan ketiga dalam interval nilai Z yang sesuai. Untuk Kr diperoleh beberapa. senyawa yang relatif stabil, terutama dengan F.

Periode kelima (Rb-Xe) dibangun serupa dengan periode keempat; ia juga memiliki sisipan 10 transisi, atau elemen d (Y-Cd). Kekhasan perubahan kekuatan unsur dalam periode: 1) pada triad Ru-Rh-Pd menunjukkan maksimal 4-8; 2) semua elemen subgrup a, termasuk Xe, menunjukkan nilai yang lebih tinggi sama dengan nomor grup; 3) Saya memiliki sifat logam yang lemah. St. Misalnya, sifat-sifat unsur pada periode keempat dan kelima berubah lebih kompleks dengan bertambahnya Z dibandingkan sifat-sifat unsur pada periode kedua dan ketiga, yang terutama disebabkan oleh adanya unsur transisi d.
Periode keenam (Cs-Rn) mengandung 32 unsur. Selain sepuluh unsur d (La, Hf-Hg), ia mencakup keluarga 14 unsur f (simbol hitam, dari Ce hingga Lu) -lantanida. Mereka sangat mirip dalam kimia. Suci bagi Anda (sebaiknya di +3) dan karena itu tidak bisa. ditempatkan menurut berbeda kelompok sistem. Dalam tabel periodik bentuk singkat, semua lantanida termasuk dalam subkelompok IIIa (La), dan totalitasnya diuraikan di bawah tabel. Teknik ini bukannya tanpa kekurangan, karena 14 elemen tampaknya berada di luar sistem.
Periode ketujuh, seperti periode keenam, seharusnya memuat 32 unsur, tetapi belum selesai. unsur Fr dan Ra masing-masing.
subgrup Ia dan IIa, Ac merupakan analog dari unsur subgrup III6. Menurut konsep aktinida G. Seaborg (1944), setelah Ac terdapat 14 unsur f (Z = 90 103). Dalam bentuk singkat tabel periodik, tabel periodik termasuk dalam Ac dan ditulis dengan cara yang sama sebagai dept. garis di bawah tabel. Teknik ini mengasumsikan adanya bahan kimia tertentu. kesamaan antara elemen dua keluarga-f.
Namun, studi rinci menunjukkan bahwa mereka menunjukkan rentang yang lebih luas, termasuk +7 (Np, Pu, Am). Selain itu, yang berat ditandai dengan stabilisasi yang lebih rendah (+2 atau bahkan +1 untuk Md). Penilaian kimia sifat Ku (Z = 104) dan Ns (Z = 105), yang disintesis menjadi sejumlah unsur tunggal yang berumur sangat pendek, memungkinkan kita untuk menyimpulkan bahwa unsur-unsur ini masing-masing adalah analog. Hf dan Ta, yaitu elemen d, dan harus ditempatkan pada subgrup IV6 dan V6.
Skema pembentukan konfigurasi elektronik, yang mendasari teori sistem periodik, dengan demikian mencerminkan urutan kemunculan tertentu seiring bertambahnya Z agregat (subkulit), yang dicirikan oleh nilai-nilai tertentu dari bilangan kuantum utama dan orbital (l). . Skema ini umumnya ditulis dalam bentuk tabel.
(lihat di bawah).
Garis vertikal memisahkan subkulit, yang diisikan ke dalam elemen-elemen yang membentuk barisan tersebut.
|
periode sistem periodik (nomor periode ditunjukkan dengan angka di atas); Subkulit yang melengkapi pembentukan cangkang dengan item tertentu disorot dalam huruf tebal. |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
||
|
Angka-angka dalam kulit dan subkulit didefinisikan pada . Sehubungan dengan , sebagai partikel dengan setengah bilangan bulat, dia mendalilkan hal itu dengan cara yang tidak mungkin. dua dengan nilai identik dari semua bilangan kuantum. Kapasitas kulit dan subkulit masing-masing sama. 2n 2 dan 2(2l+1). |
Prinsip ini tidak mendefinisikan. |
Periode |
Konfigurasi elektronik |
1 detik |
2s 2p |
3s 3p |
4s 3d 4p |
||
|
5s 4d 5p |
6s 4f 5d 6p |
22 |
33 |
434 |
545 |
6456 |
7567 |
||
|
6s 4f 5d 6p |
0 |
01 |
01 |
021 |
021 |
0321 |
0321 |
||
|
2 |
26 |
26 |
2106 |
2106 |
214106 |
214106 |
|||
|
7s 5f 6d 7p |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
||
N
aku
Jumlah unsur dalam periode
Mulai periode keenam, konstruksi konfigurasi elektronik sebenarnya menjadi lebih kompleks, yang tercermin dari pelanggaran batas yang jelas antara subkulit yang terisi secara berurutan. Misalnya, elektron 4f muncul bukan di La dengan Z = 57, tetapi di Ce berikutnya (Z = 58); berurutan konstruksi subkulit 4f terputus di Gd (Z = 64, adanya elektron 5d).
“Kaburnya periodisitas” seperti itu jelas mempengaruhi periode ketujuh untuk Z > 89, yang tercermin pada sifat-sifat unsur.
Skema sebenarnya pada awalnya tidak berasal dari k.-l. teoretis yang ketat representasi. Itu didasarkan pada kimia terkenal. elemen suci dan informasi tentang spektrumnya. Sah fisik skema sebenarnya mendapat pembenaran melalui penerapan metode pada deskripsi struktur. Dalam mekanisme kuantum. interpretasi teori struktur, konsep kulit dan subkulit elektronik dengan pendekatan yang ketat telah kehilangan makna aslinya; konsep atom kini banyak digunakan. Meski demikian, prinsip yang dikembangkan bersifat fisik Interpretasi terhadap fenomena periodisitas tidak kehilangan signifikansinya dan, pada perkiraan pertama, menjelaskan teori teoretis dengan cukup komprehensif. dasar-dasar tabel periodik. Bagaimanapun, bentuk tabel periodik yang diterbitkan mencerminkan gagasan tentang sifat distribusi di antara kulit dan subkulit.
Struktur dan sifat kimia unsur.Ciri-ciri utama kimia. perilaku unsur ditentukan oleh sifat konfigurasi kulit elektron terluar (satu atau dua). Ciri-ciri ini berbeda untuk elemen subgrup a (elemen s dan p), subgrup b (elemen d), keluarga f ( dan ).
Arti tabel periodik. Sistem ini telah memainkan dan terus memainkan peran besar dalam perkembangan pluralisme. ilmu alam disiplin ilmu.Dia menjadi penghubung penting di dermaga atom. ajaran, berkontribusi pada perumusan modern. konsep "unsur kimia" dan klarifikasi gagasan tentang zat dan senyawa sederhana. pengaruhnya terhadap perkembangan teori struktur dan munculnya konsep isotopi. Benar-benar ilmiah dikaitkan dengan sistem periodik. perumusan masalah peramalan di dalamnya
memanifestasikan dirinya baik dalam prediksi keberadaan unsur-unsur yang tidak diketahui dan sifat-sifatnya, serta ciri-ciri kimia baru. perilaku elemen yang sudah dibuka. Tabel periodik adalah dasar terpenting dari inorg.
; misalnya, ia melayani tugas mensintesis bahan dengan sifat yang telah ditentukan, membuat bahan baru, khususnya bahan semikonduktor, dan memilih bahan tertentu.
untuk perbedaan. kimia. proses. Sistem periodik bersifat ilmiah. basis pengajaran umum dan non-organisasi , serta cabang fisika atom tertentu.Lit.: Mendeleev D.I., Hukum periodik. Artikel dasar, M., 1958; Kedrov B. M.. Tiga aspek atomisme, bagian 3. Hukum Mendeleev, M., 1969; Trifonov D N., Tentang interpretasi kuantitatif periodisitas, M., 1971; Trifonov D.N., Krivomazov A.N., Lisnevsky I., Doktrin periodisitas dan doktrin. Gabungan kronologi peristiwa paling penting. M., 1974; Karapetyami MX. Drakii S.I., Stroenie, M., 1978; Doktrin periodisitas. Sejarah dan modernitas. Duduk. artikel. M.. 1981. Korolkov D.V., Fundamental, M., 1982; Melnikov V.P., Dmitriev I.S. Jenis periodisitas tambahan dalam sistem periodik D.I.
Dalam pelajaran ini Anda akan belajar tentang Hukum Periodik Mendeleev, yang menjelaskan tentang perubahan sifat-sifat benda sederhana, serta bentuk dan sifat senyawa unsur-unsur bergantung pada ukuran massa atomnya. Perhatikan bagaimana suatu unsur kimia dapat dijelaskan berdasarkan posisinya dalam Tabel Periodik.
Topik: Hukum periodik dan Tabel periodik unsur kimia oleh D. I. Mendeleev Pelajaran: Deskripsi suatu unsur berdasarkan posisinya dalam Tabel Periodik Unsur D. I. Mendeleev
Rumusan modern dari hukum periodik:“Sifat-sifat zat sederhana, serta bentuk dan sifat senyawa unsur, secara periodik bergantung pada besarnya muatan inti atom.”
Muatan inti atom sama dengan jumlah proton dalam inti atom. Jumlah proton seimbang dengan jumlah elektron dalam suatu atom. Jadi, atom bersifat netral secara listrik.
Muatan inti atom dalam tabel periodik memang demikian nomor seri elemen.
Nomor periode menunjukkan jumlah tingkat energi, tempat elektron berputar.
Nomor grup menunjukkan jumlah elektron valensi. Untuk unsur-unsur subkelompok utama, jumlah elektron valensi sama dengan jumlah elektron pada tingkat energi terluar. Elektron valensilah yang bertanggung jawab atas pembentukan ikatan kimia suatu unsur.
Unsur kimia golongan 8 - gas inert - memiliki 8 elektron di kulit elektron terluarnya. Kulit elektron seperti itu menguntungkan secara energi. Semua atom berusaha untuk mengisi kulit elektron terluarnya hingga 8 elektron.
Apa ciri-ciri atom yang berubah secara periodik dalam Tabel Periodik?
Struktur level elektronik eksternal berulang.
Jari-jari atom berubah secara berkala. Dalam kelompok radius meningkat dengan bertambahnya jumlah periode, seiring dengan bertambahnya jumlah tingkat energi. Dalam periode dari kiri ke kanan inti atom akan membesar, tetapi gaya tarik terhadap inti akan semakin besar, begitu juga dengan jari-jari atom berkurang.
Setiap atom berusaha untuk menyelesaikan tingkat energi terakhir. Unsur golongan 1 memiliki 1 elektron pada lapisan terakhir. Oleh karena itu, lebih mudah bagi mereka untuk memberikannya. Dan lebih mudah bagi unsur golongan 7 untuk menarik 1 elektron yang hilang pada oktetnya. Dalam suatu golongan, kemampuan melepaskan elektron akan meningkat dari atas ke bawah, seiring dengan bertambahnya jari-jari atom dan menurunnya daya tarik inti. Dalam periode dari kiri ke kanan, kemampuan melepaskan elektron semakin berkurang karena jari-jari atom semakin mengecil.
Semakin mudah suatu unsur melepaskan elektron dari tingkat terluarnya, semakin besar sifat logamnya, dan oksida serta hidroksidanya memiliki sifat basa yang lebih besar. Artinya sifat logam dalam golongan bertambah dari atas ke bawah, dan dalam periode dari kanan ke kiri. Dengan sifat non-logam, yang terjadi justru sebaliknya.

Beras. 1. Posisi magnesium dalam tabel
Dalam golongannya, magnesium bersebelahan dengan berilium dan kalsium. Gambar.1. Magnesium menempati peringkat lebih rendah dari berilium tetapi lebih tinggi dari kalsium dalam kelompoknya. Magnesium memiliki lebih banyak sifat logam dibandingkan berilium, tetapi lebih sedikit dibandingkan kalsium. Sifat dasar oksida dan hidroksidanya juga berubah. Pada periode tersebut, natrium berada di sebelah kiri, dan aluminium berada di sebelah kanan magnesium. Natrium akan menunjukkan lebih banyak sifat logam dibandingkan magnesium, dan magnesium akan menunjukkan lebih banyak sifat logam dibandingkan aluminium. Dengan demikian, Anda dapat membandingkan unsur apa pun dengan unsur tetangganya dalam golongan dan periode.
Sifat asam dan nonlogam berubah berlawanan dengan sifat basa dan logam.
Karakteristik klorin berdasarkan posisinya dalam tabel periodik D.I.

Beras. 4. Posisi klorin dalam tabel
. Nomor atom 17 menunjukkan jumlah proton17 dan elektron17 dalam suatu atom. Gambar.4. Massa atom 35 akan membantu menghitung jumlah neutron (35-17 = 18). Klorin berada pada periode ketiga, yang berarti jumlah tingkat energi dalam suatu atom adalah 3. Klorin termasuk dalam golongan 7-A dan termasuk dalam unsur p. Ini bukan logam. Kami membandingkan klorin dengan tetangganya dalam golongan dan periode. Sifat non-logam klorin lebih besar dibandingkan belerang, tetapi lebih kecil dibandingkan argon. Klorin memiliki sifat logam yang lebih sedikit dibandingkan fluor dan lebih banyak sifat dibandingkan brom. Mari kita distribusikan elektron ke tingkat energi dan tuliskan rumus elektron. Distribusi elektron secara keseluruhan akan terlihat seperti ini. Lihat Gambar. 5
|
|
Beras. 5. Distribusi elektron atom klor pada tingkat energi
Tentukan bilangan oksidasi klorin tertinggi dan terendah. Bilangan oksidasi tertinggi adalah +7, karena dapat melepaskan 7 elektron dari lapisan elektron terakhir. Bilangan oksidasi terendah adalah -1 karena klorin memerlukan 1 elektron untuk menyelesaikannya. Rumus oksida yang lebih tinggi Cl 2 O 7 (oksida asam), senyawa hidrogen HCl.
Dalam proses menyumbangkan atau memperoleh elektron, sebuah atom memperoleh muatan konvensional. Muatan bersyarat ini disebut .
- Sederhana zat mempunyai bilangan oksidasi sama dengan nol.
Barang mungkin dipamerkan maksimum keadaan oksidasi dan minimum. Maksimum Suatu unsur menunjukkan bilangan oksidasinya ketika memberikan semua elektron valensinya dari tingkat elektron terluar. Jika jumlah elektron valensi sama dengan nomor golongan, maka bilangan oksidasi maksimum sama dengan nomor golongan.

Beras. 2. Posisi arsenik dalam tabel
Minimum Suatu unsur akan menunjukkan keadaan oksidasi ketika itu akan menerima semua elektron yang mungkin untuk melengkapi lapisan elektron.
Mari kita perhatikan nilai bilangan oksidasi menggunakan contoh unsur No. 33.
Ini adalah arsenik As. Ini ada di subkelompok utama kelima. Ia memiliki lima elektron pada tingkat elektron terakhirnya. Artinya ketika diberikan, ia akan memiliki bilangan oksidasi +5. Atom As kekurangan 3 elektron sebelum menyelesaikan lapisan elektron. Dengan menariknya, ia akan memiliki bilangan oksidasi -3.
Kedudukan unsur logam dan nonlogam dalam Tabel Periodik D.I. Mendeleev.

Beras. 3. Kedudukan logam dan nonlogam dalam tabel
DI DALAM samping subkelompok adalah semuanya logam . Jika Anda melakukan secara mental diagonal dari boron ke astatin , Itu lebih tinggi diagonal ini di subgrup utama akan ada semuanya bukan logam , A di bawah diagonal ini adalah segalanya logam . Gambar.3.
1. No. 1-4 (hlm. 125) Rudzitis G.E. Kimia anorganik dan organik. Kelas 8: buku teks untuk lembaga pendidikan umum: tingkat dasar / G.E. Rudzitis, F.G. Feldman. M.: Pencerahan. 2011 176 hal.: sakit.
2. Ciri-ciri atom apa yang berubah seiring periodisitas?
3. Mengkarakterisasi unsur kimia oksigen menurut posisinya dalam Tabel Periodik D.I.