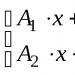Oksida CO, SiO, N 2 0, NO yang tidak membentuk garam (acuh tak acuh, acuh tak acuh).
Oksida pembentuk garam:
Dasar. Oksida yang hidratnya bersifat basa. Oksida logam dengan bilangan oksidasi +1 dan +2 (lebih jarang +3). Contoh: Na 2 O - natrium oksida, CaO - kalsium oksida, CuO - tembaga (II) oksida, CoO - kobalt (II) oksida, Bi 2 O 3 - bismut (III) oksida, Mn 2 O 3 - mangan (III) oksida).
Amfoter. Oksida yang hidratnya adalah hidroksida amfoter. Oksida logam dengan bilangan oksidasi +3 dan +4 (lebih jarang +2). Contoh: Al 2 O 3 - aluminium oksida, Cr 2 O 3 - kromium (III) oksida, SnO 2 - timah (IV) oksida, MnO 2 - mangan (IV) oksida, ZnO - seng oksida, BeO - berilium oksida.
Asam. Oksida yang hidratnya adalah asam yang mengandung oksigen. Oksida non-logam. Contoh: P 2 O 3 - fosfor oksida (III), CO 2 - karbon oksida (IV), N 2 O 5 - nitrogen oksida (V), SO 3 - sulfur oksida (VI), Cl 2 O 7 - klorin oksida ( VII). Oksida logam dengan bilangan oksidasi +5, +6 dan +7. Contoh: Sb 2 O 5 - antimon (V) oksida. CrOz - kromium (VI) oksida, MnOz - mangan (VI) oksida, Mn 2 O 7 - mangan (VII) oksida.
Perubahan sifat oksida dengan meningkatnya bilangan oksidasi logam
Sifat fisik
Oksida berbentuk padat, cair dan gas, dengan warna berbeda. Contoh: tembaga (II) oksida CuO hitam, kalsium oksida CaO putih - padatan. Sulfur oksida (VI) SO 3 adalah cairan mudah menguap yang tidak berwarna, dan karbon monoksida (IV) CO 2 adalah gas yang tidak berwarna dalam kondisi biasa.
Keadaan fisik
CaO, CuO, Li 2 O dan oksida basa lainnya; ZnO, Al 2 O 3, Cr 2 O 3, dan seterusnya. oksida amfoter; SiO 2, P 2 O 5, CrO 3 dan oksida asam lainnya.
JADI 3, Cl 2 O 7, Mn 2 O 7, dst.
Berbentuk gas:
CO 2, SO 2, N 2 O, NO, NO 2, dan seterusnya.
Kelarutan dalam air
Larut:
a) oksida basa logam alkali dan alkali tanah;
b) hampir semua oksida asam (kecuali: SiO 2).
Tidak larut:
a) semua oksida basa lainnya;
b) semua oksida amfoter
Sifat kimia
1. Sifat asam basa
Sifat umum oksida basa, asam dan amfoter adalah interaksi asam-basa, yang diilustrasikan oleh diagram berikut:


(hanya untuk oksida logam alkali dan alkali tanah) (kecuali SiO 2).

Oksida amfoter, yang memiliki sifat oksida basa dan asam, berinteraksi dengan asam kuat dan basa:

2. Oksidatif - sifat restoratif
Jika elemen tersebut memiliki derajat variabel oksidasi (s.o.), maka oksidanya dengan s rendah. HAI. dapat menunjukkan sifat pereduksi, dan oksida dengan c tinggi. HAI. - oksidatif.
Contoh reaksi di mana oksida bertindak sebagai zat pereduksi:
Oksidasi oksida dengan c rendah. HAI. menjadi oksida dengan c tinggi. HAI. elemen.
2C +2 O + O 2 = 2C +4 O 2
2S +4 O 2 + O 2 = 2S +6 O 3
2N +2 O + O 2 = 2N +4 O 2
Karbon (II) monoksida mereduksi logam dari oksidanya dan hidrogen dari air.
C +2 O + FeO = Fe + 2C +4 O 2
C +2 O + H 2 O = H 2 + 2C +4 O 2
Contoh reaksi di mana oksida bertindak sebagai zat pengoksidasi:
Reduksi oksida dengan o tinggi. unsur menjadi oksida dengan c rendah. HAI. atau ke zat sederhana.
C +4 O 2 + C = 2C +2 O
2S +6 O 3 + H 2 S = 4S +4 O 2 + H 2 O
C +4 O 2 + Mg = C 0 + 2MgO
Cr +3 2 O 3 + 2Al = 2Cr 0 + 2Al 2 O 3
Cu +2 O + H 2 = Cu 0 + H 2 O
Penggunaan oksida logam aktif rendah untuk oksidasi zat organik.

Beberapa oksida yang unsurnya mempunyai zat antara c. o., mampu melakukan disproporsi;
Misalnya:
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O
Metode memperoleh
1. Interaksi zat sederhana - logam dan nonlogam - dengan oksigen:
4Li + O 2 = 2Li 2 O;
2Cu + O 2 = 2CuO;
4P + 5O 2 = 2P 2 O 5
2. Dehidrasi basa yang tidak larut, hidroksida amfoter dan beberapa asam:
Cu(OH)2 = CuO + H2O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
H 2 JADI 3 = JADI 2 + H 2 O
H 2 SiO 3 = SiO 2 + H 2 O
3. Penguraian beberapa garam:
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
CaCO3 = CaO + CO2
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O
4. Oksidasi zat kompleks dengan oksigen:
CH 4 + 2O 2 = CO 2 + H 2 O
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
4NH 3 + 5O 2 = 4NO + 6H 2 O
5. Reduksi asam pengoksidasi dengan logam dan nonlogam:
Cu + H 2 SO 4 (konsentrasi) = CuSO 4 + SO 2 + 2H 2 O
10HNO 3 (konsentrasi) + 4Ca = 4Ca(NO 3) 2 + N 2 O + 5H 2 O
2HNO 3 (encer) + S = H 2 SO 4 + 2NO
6. Interkonversi oksida selama reaksi redoks (lihat sifat redoks oksida).
Senyawa kimia yang terdiri dari oksigen dan unsur lain dalam tabel periodik disebut oksida. Tergantung pada sifatnya, mereka diklasifikasikan menjadi basa, amfoter dan asam. Sifat oksida dapat ditentukan secara teoritis dan praktis.
Anda akan membutuhkan
- - sistem periodik;
- - peralatan gelas laboratorium;
- - reagen kimia.
instruksi
- Anda perlu memiliki pemahaman yang baik tentang bagaimana sifat-sifat unsur kimia berubah tergantung pada lokasinya di tabel D.I. Mendeleev. Jadi ulangi hukum periodik, struktur elektronik atom (bilangan oksidasi unsur bergantung padanya) dan seterusnya.
- Tanpa menggunakan langkah-langkah praktis, Anda dapat menentukan sifat oksida hanya dengan menggunakan tabel periodik. Toh diketahui dalam periode, searah dari kiri ke kanan sifat basa oksida digantikan oleh oksida amfoter, dan kemudian oleh oksida asam. Misalnya pada periode III, natrium oksida (Na2O) menunjukkan sifat basa, senyawa aluminium dengan oksigen (Al2O3) bersifat amfoter, dan klor oksida (ClO2) bersifat asam.
- Ingatlah bahwa dalam subkelompok utama sifat basa oksida meningkat dari atas ke bawah, dan sebaliknya, keasamannya melemah. Jadi, pada golongan I, cesium oksida (CsO) memiliki kebasaan yang lebih kuat dibandingkan litium oksida (LiO). Pada golongan V, nitrogen oksida (III) bersifat asam, dan bismut oksida (Bi2O5) sudah bersifat basa.
- Cara lain untuk menentukan sifat oksida. Katakanlah tugas diberikan untuk membuktikan secara eksperimental sifat basa, amfoter, dan asam dari kalsium oksida (CaO), fosfor oksida bervalensi 5 (P2O5(V)) dan seng oksida (ZnO).
- Pertama, ambil dua tabung reaksi yang bersih. Dari botol, dengan menggunakan spatula kimia, tuangkan sedikit CaO ke dalam satu botol dan P2O5 ke dalam botol lainnya. Kemudian tuangkan 5-10 ml air suling ke dalam kedua reagen. Batang kaca aduk sampai bubuk benar-benar larut. Celupkan potongan kertas lakmus ke dalam kedua tabung reaksi. Di mana kalsium oksida berada, indikatornya akan menjadi biru, yang merupakan bukti sifat dasar senyawa yang diteliti. Dalam tabung reaksi yang berisi fosfor (V) oksida, kertas akan berubah menjadi merah, oleh karena itu P2O5 merupakan oksida asam.
- Karena seng oksida tidak larut dalam air, bereaksilah dengan asam dan hidroksida untuk membuktikan bahwa seng bersifat amfoter. Dalam kedua kasus tersebut, kristal ZnO akan masuk reaksi kimia. Misalnya:
ZnO + 2KOH = K2ZnO2 + H2O
3ZnO + 2H3PO4→ Zn3(PO4)2↓ + 3H2O
Mari kita bicara tentang cara menentukan sifat oksida. Mari kita mulai dengan fakta bahwa semua zat biasanya dibagi menjadi dua kelompok: sederhana dan kompleks. Zat sederhana dibedakan menjadi logam dan nonlogam. Koneksi yang kompleks Mereka dibagi menjadi empat kelas: basa, oksida, garam, asam.
Definisi
Karena sifat oksida bergantung pada komposisinya, pertama-tama mari kita definisikan golongan ini zat anorganik. Oksida adalah oksida yang tersusun dari dua unsur. Keunikannya adalah oksigen selalu ditempatkan dalam rumus sebagai unsur kedua (terakhir).
Pilihan paling umum adalah interaksi zat sederhana (logam, nonlogam) dengan oksigen. Misalnya, ketika magnesium bereaksi dengan oksigen, ia membentuk senyawa yang menunjukkan sifat basa.

Tata nama
Sifat oksida bergantung pada komposisinya. Ada aturan tertentu dimana zat tersebut diberi nama.
Jika oksida dibentuk oleh logam dari subkelompok utama, valensinya tidak ditunjukkan. Misalnya kalsium oksida CaO. Jika logam pertama dalam senyawa tersebut adalah logam dari subgolongan serupa, yang mempunyai valensi variabel, maka harus ditunjukkan dengan angka romawi. Ditempatkan setelah nama senyawa dalam tanda kurung. Misalnya ada oksida besi (2) dan (3). Saat menyusun rumus oksida, Anda harus ingat bahwa jumlah bilangan oksidasi di dalamnya harus sama dengan nol.

Klasifikasi
Mari kita perhatikan bagaimana sifat oksida bergantung pada bilangan oksidasi. Logam dengan bilangan oksidasi +1 dan +2 membentuk oksida basa dengan oksigen. Ciri khusus senyawa tersebut adalah sifat dasar oksida. Koneksi seperti itu masuk ke dalam reaksi kimia dengan oksida non-logam pembentuk garam, membentuk garam bersamanya. Selain itu, mereka bereaksi dengan asam. Produk reaksi bergantung pada jumlah zat awal yang diambil.
Nonlogam, serta logam dengan bilangan oksidasi +4 hingga +7, membentuk oksida asam dengan oksigen. Sifat oksida menunjukkan interaksi dengan basa (alkali). Hasil interaksi tergantung pada jumlah alkali asli yang diambil. Ketika kekurangan, ia terbentuk sebagai produk interaksi garam asam. Misalnya, reaksi karbon monoksida (4) dengan natrium hidroksida menghasilkan natrium bikarbonat (garam asam).
Jika oksida asam berinteraksi dengan alkali dalam jumlah berlebih, produk reaksinya adalah garam sedang(natrium karbonat). Sifat oksida asam bergantung pada bilangan oksidasi.
Mereka dibagi menjadi oksida pembentuk garam (yang bilangan oksidasi unsurnya sama dengan nomor golongannya), serta oksida acuh tak acuh, yang tidak mampu membentuk garam.
Oksida amfoter
Ada juga sifat amfoter dari sifat oksida. Esensinya terletak pada interaksi senyawa ini dengan asam dan basa. Oksida manakah yang mempunyai sifat ganda (amfoter)? Ini termasuk senyawa biner logam dengan bilangan oksidasi +3, serta oksida berilium dan seng.

Metode memperoleh
Ada berbagai cara Pilihan paling umum adalah interaksi dengan oksigen zat sederhana(logam, non-logam). Misalnya, ketika magnesium bereaksi dengan oksigen, ia membentuk senyawa yang menunjukkan sifat basa.
Selain itu, oksida juga dapat diperoleh dengan mereaksikan zat kompleks dengan molekul oksigen. Misalnya, ketika pirit (besi sulfida 2) dibakar, dua oksida dapat diperoleh sekaligus: belerang dan besi.
Pilihan lain untuk menghasilkan oksida adalah reaksi dekomposisi garam dari asam yang mengandung oksigen. Misalnya, penguraian kalsium karbonat dapat menghasilkan karbon dioksida dan kalsium oksida
Oksida basa dan amfoter juga terbentuk selama penguraian basa yang tidak larut. Misalnya, ketika besi (3) hidroksida dikalsinasi, besi (3) oksida akan terbentuk, serta uap air.
Kesimpulan
Oksida adalah kelas zat anorganik dengan aplikasi industri yang luas. Mereka digunakan dalam industri konstruksi, industri farmasi, dan obat-obatan.
Selain itu, oksida amfoter sering digunakan dalam sintesis organik sebagai katalis (akselerator proses kimia).
instruksi
Anda perlu memiliki pemahaman yang baik tentang bagaimana sifat-sifat unsur kimia berubah tergantung pada lokasinya di tabel D.I. Mendeleev. Oleh karena itu, ulangi struktur elektronik atom (bilangan oksidasi unsur bergantung padanya) dan seterusnya.
Tanpa harus bekerja langsung, Anda dapat menentukan sifat oksida hanya dengan menggunakan tabel periodik. Bagaimanapun, diketahui bahwa dalam periode, dari kiri ke kanan, sifat basa oksida berubah menjadi amfoter, dan kemudian menjadi asam. Misalnya pada periode III, natrium oksida (Na2O) mempunyai sifat dasar, senyawa aluminium dengan oksigen (Al2O3) bersifat, dan klor oksida (ClO2) bersifat.
Ingatlah bahwa dalam subkelompok utama sifat basa oksida meningkat dari atas ke bawah, dan sebaliknya, keasamannya melemah. Jadi, pada golongan I, cesium oksida (CsO) memiliki kebasaan yang lebih kuat dibandingkan litium oksida (LiO). Pada golongan V, nitrogen oksida (III) bersifat asam, dan oksida (Bi2O5) sudah bersifat basa.
Pertama, ambil dua tabung reaksi yang bersih. Dari botol, dengan menggunakan spatula kimia, tuangkan sedikit CaO ke dalam satu botol dan P2O5 ke dalam botol lainnya. Kemudian tuangkan 5-10 ml air suling ke dalam kedua reagen. Aduk dengan batang kaca hingga bubuk benar-benar larut. Celupkan potongan kertas lakmus ke dalam kedua tabung reaksi. Di sana indikator akan berubah warna menjadi biru yang merupakan bukti sifat dasar senyawa yang diuji. Dalam tabung reaksi yang berisi fosfor (V) oksida, kertas akan berubah menjadi merah, oleh karena itu P2O5 – .
Karena seng oksida tidak larut dalam air, bereaksilah dengan asam dan hidroksida untuk membuktikan bahwa seng bersifat amfoter. Dalam kedua kasus tersebut, kristal ZnO akan masuk ke dalam reaksi kimia. Misalnya:
ZnO + 2KOH = K2ZnO2 + H2O
3ZnO + 2H3PO4→ Zn3(PO4)2↓ + 3H2O
Harap dicatat
Ingat, sifat oksida secara langsung bergantung pada valensi unsur penyusunnya.
Jangan lupa bahwa ada juga oksida acuh tak acuh (tidak membentuk garam) yang tidak bereaksi dalam kondisi normal dengan hidroksida atau asam. Ini termasuk oksida non-logam dengan valensi I dan II, misalnya: SiO, CO, NO, N2O, dll, tetapi ada juga yang “logam”: MnO2 dan beberapa lainnya.
Sumber:
- sifat dasar oksida
Oksida kalsium- Ini kapur biasa. Namun meskipun sifatnya sederhana, zat ini sangat banyak digunakan aktivitas ekonomi. Dari konstruksi, sebagai bahan dasar semen kapur, hingga memasak, sebagai bahan tambahan makanan E-529, oksida kalsium menemukan aplikasi. Baik dalam kondisi industri maupun di rumah, oksida dapat diperoleh kalsium dari karbonat kalsium reaksi dekomposisi termal.
Anda akan membutuhkan
- Kalsium karbonat berupa batu kapur atau kapur. Wadah keramik untuk anil. Obor propana atau asetilena.
instruksi
Siapkan wadah untuk anil karbonat. Pasang dengan kuat pada dudukan tahan api atau perlengkapan khusus. Wadah harus dipasang dengan kuat dan, jika memungkinkan, diamankan.
Giling karbonat kalsium. Penggilingan harus dilakukan untuk perpindahan panas yang lebih baik di dalam. Tidak perlu menggiling batu kapur atau kapur menjadi debu. Cukup untuk menghasilkan penggilingan yang kasar dan heterogen.
Isi wadah anil dengan karbonat bubuk kalsium. Jangan mengisi wadah sampai penuh, karena ketika karbon dioksida dilepaskan, sebagian zat dapat keluar. Isi wadah sekitar sepertiga penuh atau kurang.
Mulailah memanaskan wadahnya. Pasang dan amankan dengan baik. Lakukan pemanasan wadah dengan lancar sisi yang berbeda untuk menghindari kehancurannya karena ekspansi termal yang tidak merata. Lanjutkan memanaskan wadah di atas kompor gas. Setelah beberapa waktu, dekomposisi termal karbonat akan dimulai kalsium.
Tunggu bagian lengkap dekomposisi termal. Selama reaksi, lapisan atas zat dalam wadah mungkin tidak memanas dengan baik. Mereka dapat diaduk beberapa kali dengan spatula baja.
Video tentang topik tersebut
Harap dicatat
Berhati-hatilah saat bekerja dengan kompor gas dan wadah yang dipanaskan. Selama reaksi, wadah akan dipanaskan hingga suhu di atas 1200 derajat Celcius.
Saran yang berguna
Daripada mencoba membuatnya sendiri dalam jumlah besar kalsium oksida (misalnya, untuk produksi semen kapur selanjutnya), lebih baik membeli produk jadi di platform perdagangan khusus.
Sumber:
- Tuliskan persamaan reaksi yang dapat digunakan
Menurut pandangan yang diterima secara umum, asam adalah zat kompleks, terdiri dari satu atau lebih atom hidrogen yang dapat digantikan oleh atom logam dan residu asam. Mereka dibagi menjadi bebas oksigen dan mengandung oksigen, monobasa dan polibasa, kuat, lemah, dll. Bagaimana cara menentukan apakah suatu zat mempunyai sifat asam?

Anda akan membutuhkan
- - kertas indikator atau larutan lakmus;
- - asam klorida (sebaiknya encer);
- - bubuk natrium karbonat (soda ash);
- - sedikit perak nitrat dalam larutan;
- - labu atau gelas kimia alas datar.
instruksi
Tes yang pertama dan paling sederhana adalah tes dengan menggunakan kertas lakmus indikator atau larutan lakmus. Jika strip kertas atau larutan berwarna merah muda, berarti zat yang diuji mengandung ion hidrogen, dan ini merupakan tanda pasti adanya asam. Anda dapat dengan mudah memahami bahwa semakin pekat warnanya (hingga merah-merah anggur), semakin asam warnanya.
Ada banyak cara lain untuk memeriksanya. Misalnya, Anda diberi tugas untuk menentukan apakah suatu cairan bening adalah asam klorida. Bagaimana cara melakukan ini? Anda tahu reaksi terhadap ion klorida. Itu dideteksi dengan menambahkan larutan lapis - AgNO3 dalam jumlah terkecil sekalipun.
Tuang sebagian cairan uji ke dalam wadah terpisah dan masukkan sedikit larutan lapis. Dalam hal ini, endapan putih “mengental” dari perak klorida yang tidak larut akan langsung terbentuk. Artinya, pasti ada ion klorida dalam molekul zat tersebut. Tapi mungkin itu bukan larutan garam yang mengandung klorin? Misalnya, natrium klorida?
Ingat sifat asam yang lain. Asam kuat(dan asam klorida tentunya salah satunya) dapat menggantikan asam lemah darinya. Masukkan sedikit bubuk soda - Na2CO3 - ke dalam labu atau gelas kimia dan tambahkan cairan yang akan diuji secara perlahan. Jika segera terdengar suara mendesis dan bubuk itu benar-benar “mendidih”, tidak ada keraguan lagi - itu adalah asam klorida.
Mengapa? Karena reaksinya adalah: 2HCl + Na2CO3 = 2NaCl + H2CO3. Asam karbonat terbentuk, yang sangat lemah sehingga langsung terurai menjadi air dan karbon dioksida. Gelembung-gelembungnyalah yang menyebabkan “mendidih dan mendesis” ini.
Video tentang topik tersebut
Harap dicatat
Asam klorida, bahkan encer – zat kaustik! Ingat tindakan pencegahan keselamatan.
Saran yang berguna
Dalam situasi apa pun Anda tidak boleh melakukan tes rasa (jika lidah Anda terasa asam, berarti ada asam). Paling tidak, ini bisa sangat berbahaya! Lagi pula, banyak asam yang sangat kaustik.
Sumber:
- bagaimana sifat asam berubah pada tahun 2019
Fosfor – unsur kimia, memiliki nomor urut ke-15 dalam Tabel Periodik. Itu terletak di grup V-nya. Non-logam klasik ditemukan oleh alkemis Brand pada tahun 1669. Ada tiga modifikasi utama fosfor: merah (bagian dari campuran korek api), putih dan hitam. Sangat tekanan tinggi(sekitar 8,3 * 10^10 Pa), fosfor hitam berubah menjadi keadaan alotropik lain (“fosfor logam”) dan mulai menghantarkan arus. fosfor masuk berbagai zat?

instruksi
Ingat, gelar. Ini adalah nilai yang sesuai dengan muatan ion dalam molekul, asalkan pasangan elektron, yang melakukan koneksi, digeser ke arah unsur yang lebih elektronegatif (terletak di kanan dan lebih tinggi dalam Tabel Periodik).
Anda juga perlu mengetahui syarat utamanya: jumlahnya muatan listrik semua ion yang menyusun molekul, dengan memperhitungkan koefisiennya, harus selalu sama dengan nol.
Bilangan oksidasi tidak selalu secara kuantitatif bertepatan dengan valensi. Contoh terbaik– karbon, yang dalam bahan organik selalu bernilai 4, dan bilangan oksidasinya bisa sama dengan -4, dan 0, dan +2, dan +4.
Misalnya, berapa bilangan oksidasi pada molekul fosfin PH3? Secara keseluruhan, pertanyaan ini sangat mudah dijawab. Karena hidrogen adalah unsur pertama dalam Tabel Periodik, menurut definisi, hidrogen tidak dapat ditempatkan “di sebelah kanan dan lebih tinggi” dari . Oleh karena itu, fosforlah yang akan menarik elektron hidrogen.
Setiap atom hidrogen, setelah kehilangan elektron, akan berubah menjadi ion oksidasi bermuatan positif +1. Oleh karena itu, totalnya muatan positif sama dengan +3. Artinya, memperhatikan aturan yang menyatakan bahwa muatan total molekul sama dengan nol, bilangan oksidasi fosfor dalam molekul fosfin adalah -3.
Nah, bagaimana bilangan oksidasi fosfor pada oksida P2O5? Ambil Tabel Periodik. Oksigen terletak di golongan VI, di sebelah kanan fosfor, dan juga lebih tinggi, oleh karena itu pasti lebih elektronegatif. Artinya, bilangan oksidasi oksigen dalam senyawa ini akan bertanda minus, dan bilangan oksidasi fosfor akan bertanda plus. Berapa derajat agar molekul secara keseluruhan bersifat netral? Anda dapat dengan mudah melihat bahwa kelipatan persekutuan terkecil dari angka 2 dan 5 adalah 10. Oleh karena itu, bilangan oksidasi oksigen adalah -2, dan fosfor adalah +5.
Video tentang topik tersebut
Dalam tugas ini Anda perlu membuktikan sifat oksida berikut:
Tuliskan urutan penentuan sifat setiap oksida.
- Pertama, tentukan sifat apa yang dimiliki setiap oksida;
- Selanjutnya, tuliskan definisi masing-masing properti;
- Tulis persamaan reaksi yang mengkonfirmasi sifat masing-masing oksida.
Tentukan sifat-sifat oksida timah
SnO - timah oksida. Memiliki sifat amfoter Oleh karena itu, oksida ini dapat bereaksi dengan asam dan basa. Dalam hal ini sifat dasar oksida ini lebih dominan.
Reaksi dengan asam encer.
SnO + H2SO4 = SnSO4 + H2O.
Reaksi dengan asam pekat.
SnO + 3HCl = H + H2O.
Reaksi dengan basa.
SnO + 2NaOH = Na2SnO2 + H2O.
Tentukan sifat-sifat kalsium oksida
CaO - kalsium oksida. Oksida ini memiliki sifat dasar. Oleh karena itu oksida ini bereaksi dengan asam dan oksida asam membentuk garam.
Persamaan reaksi karakteristik.
Reaksi dengan oksida asam.
CaO + SO2 = CaSO3.
Reaksi dengan asam.
CaO + 2HCl = CaCl2 + H2O.
Tentukan sifat-sifat karbon dioksida
CO2 - karbon dioksida. Oksida ini merupakan oksida asam karena bereaksi dengan oksida basa dan basa membentuk garam.
Persamaan reaksi karakteristik.
Reaksi dengan oksida basa.
CO2 + Na2O = Na2CO3.
Reaksi dengan basa.
CO2 + 2NaOH = Na2CO3 + H2O.
tidak. oksida timah. Timah(II) oksida stabil di udara, bersifat amfoter dengan dominasi sifat dasar. Sedikit larut dalam air dan larutan alkali encer.
SnO + 2NaOH = Na2SnO2 + H2O.
Larut dalam asam encer.
SnO + H2SO4 = SnSO4 + H2O
Larut dalam asam pekat.
SnO + 3HCl = H + H2O
CaO. Kalsium oksida adalah oksida basa. Bagaimana oksida basa bereaksi dengan oksida asam dan asam membentuk garam.
CaO + SO2 = CaSO3
CaO + 2HCl = CaCl2 + H2O
CO2. Karbon monoksida. Oleh sifat kimia Karbon dioksida adalah oksida asam. Ketika dilarutkan dalam air, ia terbentuk asam karbonat. Bereaksi dengan basa membentuk karbonat dan bikarbonat.
CaO + CO2 = CaCO3.
KOH + CO2 = KHCO3.