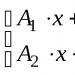Asam mono (NaOH, KOH, NH 4 OH, dll.);
Diacid (Ca(OH)2, Cu(OH)2, Fe(OH)2;
Tiga asam (Ni(OH) 3, Co(OH) 3, Mn(OH) 3.
Klasifikasi menurut kelarutan dalam air dan derajat ionisasi:
Basa kuat yang larut dalam air
Misalnya:
alkali - hidroksida logam alkali dan alkali tanah LiOH - litium hidroksida, NaOH - natrium hidroksida (soda kaustik), KOH - kalium hidroksida (kalium kaustik), Ba(OH) 2 - barium hidroksida;
Basa kuat yang tidak larut dalam air
Misalnya:
Cu(OH) 2 - tembaga (II) hidroksida, Fe(OH) 2 - besi (II) hidroksida, Ni(OH) 3 - nikel (III) hidroksida.
Sifat kimia
1. Tindakan terhadap indikator
Lakmus - biru;
Metil oranye - kuning,
Fenolftalein - raspberry.
2. Interaksi dengan oksida asam
2KOH + CO 2 = K 2 CO 3 + H 2 O
KOH + CO2 = KHCO3
3. Interaksi dengan asam (reaksi netralisasi)
NaOH + HNO 3 = NaNO 3 + H 2 O; Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
4. Reaksi pertukaran dengan garam
Ba(OH)2 + K2SO4 = 2KOH + BaSO4
3KOH + Fe(NO 3) 3 = Fe(OH) 3 + 3KNO 3
5. Dekomposisi termal
Cu(OH) 2 t = CuO + H 2 O; 2 CuOH = Cu 2 O + H 2 O
2Co(OH) 3 = Co 2 O 3 + ZH 2 O; 2AgOH = Ag 2 O + H 2 O
6. Hidroksida yang logam dnya rendah c. o., mampu teroksidasi oleh oksigen atmosfer,
Misalnya:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
2Mn(OH) 2 + O 2 + 2H 2 O = 2Mn(OH) 4
7. Larutan alkali berinteraksi dengan hidroksida amfoter:
2KOH + Zn(OH) 2 = K 2
2KON + Al 2 O 3 + ZN 2 O = 2K
8. Larutan alkali berinteraksi dengan logam yang terbentuk oksida amfoter hidroksida (Zn, AI, dll.),
Misalnya:
Zn + 2 NaOH + 2H 2 O = Na 2 + H 2
2AI + 2KOH + 6H 2 O= 2KAl(OH) 4 ] + 3H 2
9. Dalam larutan alkali, beberapa nonlogam tidak proporsional,
Misalnya:
Cl 2 + 2NaOH = NaCl + NaCIO + H 2 O
3S+ 6NaOH = 2Na 2 S+ Na 2 SO 3 + 3H 2 O
4P+ 3KOH + 3H 2 O = PH 3 + 3KH 2 PO 2
10. Basa larut banyak digunakan dalam berbagai reaksi hidrolisis basa senyawa organik(hidrokarbon terhalogenasi, ester, lemak, dll.),
Misalnya:
C 2 H 5 CI + NaOH = C 2 H 5 OH + NaCl
Metode untuk memperoleh alkali dan basa yang tidak larut
1. Reaksi logam aktif (logam alkali dan alkali tanah) dengan air:
2Na + 2H 2 O = 2 NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
2. Interaksi oksida logam aktif dengan air:
BaO + H 2 O = Ba(OH) 2
3. Elektrolisis larutan garam berair:
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2
CaCI 2 + 2H 2 O = Ca(OH) 2 + H 2 + Cl 2
4. Pengendapan dari larutan garam yang sesuai dengan basa:
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
FeCI 3 + 3KOH = Fe(OH) 3 + 3KCI
Basa (hidroksida) – zat kompleks, molekulnya mengandung satu atau lebih gugus hidroksi OH. Paling sering, basa terdiri dari atom logam dan gugus OH. Misalnya, NaOH adalah natrium hidroksida, Ca(OH) 2 adalah kalsium hidroksida, dll.
Ada basa - amonium hidroksida, di mana gugus hidroksi terikat bukan pada logam, tetapi pada ion NH 4 + (kation amonium). Amonium hidroksida terbentuk ketika amonia dilarutkan dalam air (reaksi penambahan air ke amonia):
NH 3 + H 2 O = NH 4 OH (amonium hidroksida).
Valensi gugus hidroksi adalah 1. Jumlah gugus hidroksil dalam molekul basa bergantung pada valensi logam dan sama dengan valensi tersebut. Misalnya NaOH, LiOH, Al (OH) 3, Ca(OH) 2, Fe(OH) 3, dll.
Semua alasan - padatan, yang memiliki warna berbeda. Beberapa basa sangat larut dalam air (NaOH, KOH, dll.). Namun sebagian besarnya tidak larut dalam air.
Basa yang larut dalam air disebut basa. Larutan alkali bersifat “sabun”, licin saat disentuh dan cukup pedas. Alkali meliputi hidroksida logam alkali dan alkali tanah (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH) 2, Sr(OH) 2, Ba(OH) 2, dll.). Sisanya tidak dapat larut.
Basa yang tidak larut- Ini hidroksida amfoter, yang bertindak sebagai basa ketika berinteraksi dengan asam, dan berperilaku seperti asam ketika berinteraksi dengan basa.
Basa yang berbeda mempunyai kemampuan yang berbeda-beda dalam menghilangkan gugus hidroksi, sehingga dibedakan menjadi basa kuat dan basa lemah.
Basa kuat dalam larutan air dengan mudah melepaskan gugus hidroksinya, sedangkan basa lemah tidak.
 Sifat kimia basa
Sifat kimia basa
Sifat kimia basa dicirikan oleh hubungannya dengan asam, anhidrida asam, dan garam.
1. Bertindak berdasarkan indikator. Indikator berubah warna tergantung interaksi dengan yang berbeda bahan kimia. Dalam larutan netral mereka memiliki satu warna, dalam larutan asam mereka memiliki warna lain. Saat berinteraksi dengan basa, mereka berubah warna: indikator metil jingga berubah kuning, indikator lakmus - masuk biru, dan fenolftalein menjadi fuchsia.
2. Berinteraksi dengan oksida asam dengan pembentukan garam dan air:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. Bereaksi dengan asam, membentuk garam dan air. Reaksi basa dengan asam disebut reaksi netralisasi, karena setelah selesai mediumnya menjadi netral:
2KOH + H 2 JADI 4 → K 2 JADI 4 + 2H 2 O.
4. Bereaksi dengan garam membentuk garam dan basa baru:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. Saat dipanaskan, mereka dapat terurai menjadi air dan oksida basa:
Cu(OH)2 = CuO + H2O.
Masih ada pertanyaan? Ingin tahu lebih banyak tentang yayasan?
Untuk mendapatkan bantuan dari tutor, daftarlah.
Pelajaran pertama gratis!
situs web, ketika menyalin materi secara keseluruhan atau sebagian, diperlukan tautan ke sumbernya.
Sifat umum basa ditentukan oleh adanya ion OH - dalam larutannya, yang menciptakan lingkungan basa dalam larutan (fenolftalein berubah warna menjadi merah tua, jingga metil menjadi kuning, lakmus menjadi biru).
1. Sifat kimia basa:
1) interaksi dengan oksida asam:
2KOH+CO 2 ®K 2 CO 3 +H 2 O;
2) reaksi dengan asam (reaksi netralisasi):
2NaOH+ H 2 JADI 4 ®Na 2 JADI 4 +2H 2 O;
3) interaksi dengan garam larut (hanya jika, ketika terkena alkali, garam larut terjadi pengendapan atau pelepasan gas):
2NaOH+ CuSO 4 ®Cu(OH) 2 ¯+Na 2 SO 4,
Ba(OH) 2 +Na 2 SO 4 ®BaSO 4 ¯+2NaOH, KOH(conc.)+NH 4 Cl(kristal) ®NH 3 +KCl+H 2 O.
2. Sifat kimia basa tidak larut:
1) interaksi basa dengan asam:
Fe(OH) 2 +H 2 SO 4 ®FeSO 4 +2H 2 O;
2) dekomposisi saat dipanaskan. Basa yang tidak larut terurai ketika dipanaskan menjadi oksida basa dan air:
Cu(OH) 2 ®CuO+H 2 O
Akhir pekerjaan -
Topik ini termasuk dalam bagian:
Studi molekuler atom dalam kimia. Atom. Molekul. Unsur kimia. mol. Zat kompleks sederhana. Contoh
Secara atom ajaran molekuler dalam kimia atom molekul unsur kimia mol contoh zat kompleks sederhana.. landasan teori kimia modern adalah atom-molekuler.. atom adalah partikel kimia terkecil yang menjadi batas kimia..
Jika Anda membutuhkannya materi tambahan tentang topik ini, atau Anda tidak menemukan apa yang Anda cari, kami sarankan menggunakan pencarian di database karya kami:
Apa yang akan kami lakukan dengan materi yang diterima:
Jika materi ini bermanfaat bagi Anda, Anda dapat menyimpannya ke halaman Anda di jejaring sosial:
| Menciak |
Semua topik di bagian ini:
Mendapatkan alasan
1. Pembuatan basa: 1) interaksi logam alkali atau alkali tanah atau oksidanya dengan air: Ca+2H2O®Ca(OH)2+H
Tata nama asam
Nama asam diambil dari unsur pembentuk asam tersebut. Apalagi di judulnya asam bebas oksigen biasanya ada akhiran -hidrogen: HCl - hidroklorik, HBr - hidrogen bromida
Sifat kimia asam
Sifat umum asam dalam larutan air ditentukan oleh adanya ion H+ yang terbentuk selama disosiasi molekul asam, sehingga asam adalah donor proton: HxAn«xH+
Memperoleh asam
1) interaksi oksida asam dengan air: SO3+H2O®H2SO4, P2O5+3H2O®2H3PO4;
Sifat kimia garam asam
1) garam asam mengandung atom hidrogen yang dapat mengambil bagian dalam reaksi netralisasi, sehingga dapat bereaksi dengan basa, berubah menjadi garam asam sedang atau lainnya - dengan jumlah yang lebih kecil
Memperoleh garam asam
Garam asam dapat diperoleh: 1) melalui reaksi netralisasi tidak sempurna asam polibasa dengan basa: 2H2SO4+Cu(OH)2®Cu(HSO4)2+2H
Garam dasar.
Basa (garam hidrokso) adalah garam yang terbentuk sebagai hasil penggantian tidak sempurna ion hidroksida basa dengan anion asam.
Basa asam tunggal, misalnya NaOH, KOH,
Sifat kimia garam basa
1) garam basa mengandung gugus hidrokso yang dapat ikut serta dalam reaksi netralisasi, sehingga dapat bereaksi dengan asam, berubah menjadi garam antara atau garam basa dengan lebih sedikit
Persiapan garam dasar
Garam basa dapat diperoleh: 1) melalui reaksi netralisasi basa yang tidak sempurna dengan asam: 2Cu(OH)2+H2SO4®(CuOH)2SO4+2H2
garam sedang.
Garam sedang adalah produk penggantian lengkap ion H+ dari suatu asam dengan ion logam; mereka juga dapat dianggap sebagai produk penggantian lengkap ion OH dari anion basa
Tata nama garam sedang
Dalam tata nama Rusia (digunakan dalam praktik teknologi), terdapat urutan penamaan garam medium sebagai berikut: kata tersebut ditambahkan ke akar nama asam yang mengandung oksigen
Sifat kimia garam sedang 1) Hampir semua garam merupakan senyawa ionik, oleh karena itu dalam bentuk lelehan dan dalam larutan berair
mereka berdisosiasi menjadi ion (ketika arus dialirkan melalui larutan atau garam cair, proses elektrolisis terjadi).
Persiapan garam sedang Paling
metode untuk memperoleh garam didasarkan pada interaksi zat yang sifatnya berlawanan - logam dengan non-logam, oksida asam dengan basa, basa dengan asam (lihat Tabel 2).
Struktur atom. Atom adalah partikel netral secara listrik yang terdiri dari inti bermuatan positif dan elektron bermuatan negatif. Nomor seri elemen di tabel periodik
unsur sama dengan muatan inti
Inti atom terdiri dari proton dan neutron.
Jumlah proton sama dengan nomor atom suatu unsur. Jumlah neutron dalam inti sama dengan selisih antara nomor massa isotop dan
Elektron
Elektron berputar mengelilingi inti dalam orbit stasioner tertentu. Bergerak sepanjang orbitnya, elektron tidak memancarkan atau menyerap energi elektromagnetik. Terjadi emisi atau penyerapan energi
Aturan untuk mengisi level elektronik, sublevel elemen Banyaknya elektron yang dapat berada pada satu tingkat energi ditentukan dengan rumus 2n2, dimana n adalah bilangan tingkat tersebut. Pengisian maksimal empat yang pertama tingkat energi
: untuk yang pertama
Energi ionisasi, afinitas elektron, elektronegativitas.
Energi ionisasi suatu atom. Energi yang diperlukan untuk melepaskan elektron dari atom yang tidak tereksitasi disebut energi ionisasi pertama (potensial) I: E + I = E+ + e- Energi ionisasi
Ikatan kovalen
Dalam kebanyakan kasus, ketika suatu ikatan terbentuk, elektron-elektron dari atom-atom yang terikat digunakan bersama. Jenis ikatan kimia ini disebut ikatan kovalen (awalan “co-” dalam bahasa Latin
Koneksi sigma dan pi. Ikatan Sigma (σ)-, pi (π) - deskripsi perkiraan jenis ikatan kovalen dalam molekul berbagai koneksi
, kopling σ dicirikan oleh fakta bahwa kerapatan awan elektron maksimum
Pembentukan ikatan kovalen melalui mekanisme donor-akseptor. Selain apa yang dinyatakan dalam bagian sebelumnya
mekanisme homogen untuk pembentukan ikatan kovalen, ada mekanisme heterogen - interaksi ion bermuatan berlawanan - proton H+ dan
Ikatan kimia dan geometri molekul. BI3, PI3
Gambar 3.1 Penambahan unsur dipol pada molekul NH3 dan NF3
Ikatan polar dan non-polar Ikatan kovalen terbentuk sebagai hasil sosialisasi elektron (dengan pembentukan common pasangan elektron
), yang terjadi ketika awan elektron tumpang tindih. Dalam pendidikan
Ikatan ionik Ikatan ionik
adalah ikatan kimia yang terjadi melalui interaksi elektrostatik ion-ion yang bermuatan berlawanan.
Demikianlah proses pendidikan dan Keadaan oksidasi Valensi 1. Valensi adalah kemampuan atom unsur kimia membentuk
nomor tertentu
ikatan kimia. 2. Nilai valensi bervariasi dari I sampai VII (jarang VIII). Valen Ikatan hidrogen Selain berbagai ikatan heteropolar dan homeopolar, ada satu lagi
jenis khusus
Jadi, struktur kristal dicirikan oleh susunan partikel yang benar (teratur) di tempat-tempat tertentu dalam kristal. Ketika Anda secara mental menghubungkan titik-titik ini dengan garis, Anda mendapatkan spasi.
Solusi
Jika Anda menempatkan kristal dalam bejana berisi air garam meja, gula atau kalium permanganat (kalium permanganat), maka kita dapat mengamati bagaimana jumlah zat padat berangsur-angsur berkurang. Pada saat yang sama, air
Disosiasi elektrolitik
Larutan semua zat dapat dibagi menjadi dua kelompok: elektrolit - konduksi arus listrik, non-elektrolit bukanlah konduktor. Pembagian ini bersyarat, karena semuanya
Mekanisme disosiasi.
Molekul air bersifat dipol, yaitu salah satu ujung molekul bermuatan negatif, ujung lainnya bermuatan positif. Molekul tersebut memiliki kutub negatif yang mendekati ion natrium, dan kutub positif mendekati ion klor; mengelilingi io
Produk ionik air
nilai pH(pH) adalah nilai yang mencirikan aktivitas atau konsentrasi ion hidrogen dalam larutan. Indikator hidrogen disebut pH. Indeks hidrogen secara numerik
Reaksi kimia
Reaksi kimia adalah transformasi suatu zat menjadi zat lain. Namun definisi ini memerlukan satu tambahan yang signifikan. DI DALAM reaktor nuklir atau di akselerator juga, beberapa zat diubah
Metode penyusunan koefisien dalam OVR
Metode saldo elektronik 1). Kami menulis persamaannya reaksi kimia KI + KMnO4 → I2 + K2MnO4 2). Menemukan atom
Hidrolisis
Hidrolisis merupakan suatu proses interaksi pertukaran antara ion garam dan air yang mengakibatkan terbentuknya zat-zat yang sedikit terdisosiasi dan disertai dengan perubahan reaksi (pH) medium.
Intinya
Laju reaksi kimia Laju reaksi ditentukan oleh perubahan tersebut konsentrasi molar
salah satu reaktan: V = ± ((C2 – C1) / (t2 - t
Faktor-faktor yang mempengaruhi laju reaksi kimia 1. Sifat zat yang bereaksi. Peran besar
berperan dalam sifat ikatan kimia dan struktur molekul reagen. Reaksi berlangsung menuju penghancuran ikatan yang kurang kuat dan pembentukan zat dengan
Energi aktivasi
Tumbukan partikel-partikel kimia menimbulkan interaksi kimia hanya jika partikel-partikel yang bertabrakan mempunyai energi melebihi nilai tertentu. Mari kita pertimbangkan satu sama lain
Katalis katalisis
Banyak reaksi yang dapat dipercepat atau diperlambat dengan adanya zat tertentu. Zat yang ditambahkan tidak ikut serta dalam reaksi dan tidak dikonsumsi selama reaksi, tetapi mempunyai pengaruh yang signifikan
Reaksi kimia yang berlangsung dengan laju yang sebanding di kedua arah disebut reversibel. Dalam reaksi seperti itu, campuran kesetimbangan reagen dan produk terbentuk, yang komposisinya
Prinsip Le Chatelier
Prinsip Le Chatelier menyatakan bahwa untuk menggeser kesetimbangan ke kanan, tekanan harus dinaikkan terlebih dahulu. Memang, ketika tekanan meningkat, sistem akan “menolak” peningkatan con
Faktor-faktor yang mempengaruhi laju reaksi kimia
Faktor-faktor yang mempengaruhi laju reaksi kimia Menambah kecepatan Mengurangi kecepatan Adanya reagen yang aktif secara kimia
hukum Hess
Menggunakan nilai tabel
Efek termal
Selama reaksi, ikatan pada zat awal terputus dan ikatan baru terbentuk pada produk reaksi. Karena pembentukan ikatan terjadi dengan pelepasan, dan pemutusan ikatan terjadi dengan penyerapan energi, maka x
Pembagian pangkalan menjadi kelompok-kelompok menurut berbagai tanda disajikan pada tabel 11.
Tabel 11
Klasifikasi pangkalan
Semua basa, kecuali larutan amonia dalam air, merupakan zat padat dengan warna berbeda. Misalnya kalsium hidroksida Ca(OH)2 putih, tembaga (II) hidroksida Cu(OH) 2 warna biru, nikel (II) hidroksida Ni(OH) 2 hijau, besi (III) hidroksida Fe(OH) 3 berwarna merah coklat, dan seterusnya.
Larutan amonia NH 3 H 2 O dalam air, tidak seperti basa lainnya, tidak mengandung kation logam, tetapi kation amonium kompleks bermuatan tunggal NH - 4 dan hanya ada dalam larutan (Anda mengetahui larutan ini sebagai amonia). Ini mudah terurai menjadi amonia dan air:
Namun, betapapun berbedanya basa, semuanya terdiri dari ion logam dan gugus hidrokso, yang jumlahnya sama dengan bilangan oksidasi logam.
Semua basa, terutama basa ( elektrolit kuat), terbentuk melalui disosiasi ion hidroksida OH - , yang menentukan deretnya sifat umum: rasa sabun saat disentuh, perubahan warna indikator (lakmus, jingga metil dan fenolftalein), interaksi dengan zat lain.
Reaksi basa yang khas

Reaksi pertama (universal) dibahas dalam § 38.
Percobaan laboratorium No.23
Interaksi basa dengan asam
- Tuliskan dua persamaan molekul reaksi, yang intinya dinyatakan dengan persamaan ionik berikut:
H + + OH - = H 2 O.
Jalankan reaksi yang persamaannya telah Anda buat. Ingatlah zat apa saja (kecuali asam dan basa) yang dibutuhkan untuk mengamati reaksi kimia tersebut.
Reaksi kedua terjadi antara basa dan oksida non-logam, yang berhubungan dengan asam, misalnya,
Sesuai
![]()
![]() dll.
dll.
Ketika oksida berinteraksi dengan basa, garam dari asam dan air yang sesuai terbentuk:


Beras. 141.
Interaksi alkali dengan oksida non-logam
Percobaan laboratorium No.24
Interaksi basa dengan oksida non-logam
Ulangi percobaan yang Anda lakukan sebelumnya. Tuang 2-3 ml larutan bening air kapur ke dalam tabung reaksi.
Tempatkan sedotan jus di dalamnya, yang berfungsi sebagai tabung saluran keluar gas. Lewatkan udara yang dihembuskan secara perlahan ke dalam larutan. Apa yang kamu amati?
Tuliskan persamaan molekul dan ion untuk reaksi tersebut.

Beras. 142.
Interaksi basa dengan garam:
a - dengan pembentukan sedimen; b - dengan pembentukan gas
Reaksi ketiga merupakan reaksi pertukaran ion yang khas dan hanya terjadi jika menghasilkan endapan atau gas yang dilepaskan, misalnya:

Percobaan laboratorium No.25
Interaksi basa dengan garam
- Tuang 1-2 ml larutan zat berpasangan ke dalam tiga tabung reaksi: tabung reaksi pertama - natrium hidroksida dan amonium klorida; tabung reaksi ke-2 - kalium hidroksida dan besi (III) sulfat; Tabung reaksi ke-3 - natrium hidroksida dan barium klorida.
Panaskan isi tabung reaksi pertama dan identifikasi salah satu produk reaksi berdasarkan baunya.
Merumuskan kesimpulan tentang kemungkinan interaksi basa dengan garam.
Basa yang tidak larut bila dipanaskan terurai menjadi oksida logam dan air, hal ini tidak khas untuk basa, misalnya:
Fe(OH)2 = FeO + H2O.
Percobaan laboratorium No.26
Persiapan dan sifat basa tidak larut
Tuang 1 ml larutan tembaga (II) sulfat atau klorida ke dalam dua tabung reaksi. Tambahkan 3-4 tetes larutan natrium hidroksida ke setiap tabung reaksi. Jelaskan tembaga(II) hidroksida yang terbentuk.
Catatan. Tinggalkan tabung reaksi dengan tembaga (II) hidroksida yang dihasilkan untuk percobaan selanjutnya.
Menyusun molekul dan persamaan ionik reaksi yang dilakukan. Tunjukkan jenis reaksi berdasarkan “jumlah dan komposisi zat awal dan produk reaksi”.
Tambahkan 1-2 ml tembaga (II) hidroksida yang diperoleh pada percobaan sebelumnya ke dalam salah satu tabung reaksi asam klorida. Apa yang kamu amati?
Dengan menggunakan pipet, letakkan 1-2 tetes larutan yang dihasilkan pada piring kaca atau porselen dan, dengan menggunakan penjepit wadah, evaporasi dengan hati-hati. Periksa kristal yang terbentuk. Perhatikan warnanya.
Tuliskan persamaan molekul dan ion untuk reaksi tersebut. Tunjukkan jenis reaksi berdasarkan “jumlah dan komposisi bahan awal dan produk reaksi”, “partisipasi katalis”, dan “reversibilitas reaksi kimia”.
Panaskan salah satu tabung reaksi dengan tembaga hidroksida () yang diperoleh sebelumnya atau diberikan oleh guru (Gbr. 143). Apa yang kamu amati?

Beras. 143.
Penguraian tembaga(II) hidroksida bila dipanaskan
Buatlah persamaan reaksi yang dilakukan, tunjukkan kondisi terjadinya dan jenis reaksi berdasarkan ciri-ciri “jumlah dan komposisi zat awal dan produk reaksi”, “pelepasan atau penyerapan panas” dan “reversibilitas suatu bahan kimia. reaksi".
Kata kunci dan frase
- Klasifikasi pangkalan.
- Sifat khas basa: interaksinya dengan asam, oksida non-logam, garam.
- Sifat khas basa tidak larut adalah dekomposisi ketika dipanaskan.
- Kondisi aliran reaksi khas alasan.
Bekerja dengan komputer
- Lihat aplikasi elektronik. Pelajari materi pelajaran dan selesaikan tugas yang diberikan.
- Cari di Internet alamat email, yang dapat melayani sumber tambahan, mengungkapkan isi kata kunci dan frase dalam paragraf. Tawarkan bantuan Anda kepada guru dalam mempersiapkan pelajaran baru - kirim pesan lewat kata kunci dan frasa di paragraf berikutnya.
Pertanyaan dan tugas