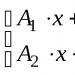Konsep kelarutan digunakan dalam kimia untuk menggambarkan sifat-sifat zat padat yang bercampur dan larut dalam cairan. Hanya senyawa ionik (bermuatan) yang larut sempurna. Untuk keperluan praktis, cukup mengingat beberapa aturan atau dapat menemukannya agar dapat digunakan sesekali dan mengetahui apakah zat ionik tertentu akan larut atau tidak dalam air. Faktanya, sejumlah atom tetap larut, meskipun perubahannya tidak terlihat, sehingga untuk melakukan eksperimen yang akurat terkadang perlu menghitung jumlah ini.
Tangga
Menggunakan aturan sederhana
-
Pelajari lebih lanjut tentang senyawa ionik. Dalam keadaan normal, setiap atom memiliki sejumlah elektron tertentu, namun terkadang dapat menangkap atau kehilangan satu elektron tambahan. Sebagai akibat, ion, yang bermuatan listrik. Jika ion bermuatan negatif (ekstra elektron) bertemu dengan ion bermuatan positif (tanpa elektron), keduanya akan berikatan seperti kutub berlawanan dari dua magnet. Akibatnya, senyawa ionik terbentuk.
- Ion yang bermuatan negatif disebut anion, dan ion dengan muatan positif - kation.
- Dalam keadaan normal, jumlah elektron dalam suatu atom sama dengan jumlah proton, sehingga atom bersifat netral secara kelistrikan.
-
Pelajari lebih lanjut tentang kelarutan. Molekul air (H 2 O) memiliki struktur yang khas, sehingga mirip dengan magnet: mereka memiliki muatan positif di satu ujung dan muatan negatif di ujung lainnya. Ketika senyawa ionik ditempatkan dalam air, “magnet” air ini berkumpul di sekitar molekulnya dan cenderung menarik ion positif dan negatif satu sama lain. Molekul beberapa senyawa ionik tidak terlalu kuat, dan zat semacam itu larut dalam air, karena molekul air menarik ion satu sama lain dan melarutkannya. Dalam senyawa lain, ion-ionnya terikat lebih erat, dan mereka tidak larut, karena molekul air tidak mampu memisahkan ion-ionnya.
- Dalam molekul beberapa senyawa, kekuatan ikatan internal sebanding dengan aksi molekul air. Koneksi seperti itu disebut sedikit larut, karena sebagian besar molekulnya terdisosiasi, meskipun sebagian lainnya tetap tidak larut.
-
Pelajari aturan kelarutan. Karena interaksi antar atom digambarkan oleh hukum yang agak rumit, tidak selalu mungkin untuk segera mengatakan zat mana yang larut dan mana yang tidak. Temukan salah satu ion senyawa dalam uraian di bawah tentang perilaku berbagai zat. Kemudian lihat ion kedua dan lihat apakah ini merupakan pengecualian karena interaksi ion yang tidak biasa.
- Katakanlah Anda berurusan dengan strontium klorida (SrCl 2). Temukan ion Sr dan Cl pada langkah-langkah di bawah ini (yang dicetak tebal). Cl "biasanya larut"; setelah itu, lihat pengecualian di bawah ini. Ion Sr tidak disebutkan disana, sehingga senyawa SrCl harus larut dalam air.
- Di bawah aturan yang relevan adalah pengecualian yang paling umum. Ada pengecualian lain, tetapi kemungkinan besar Anda tidak akan menemukannya di kelas kimia atau di laboratorium.
-
Suatu senyawa dikatakan larut jika mengandung ion logam alkali yaitu Li+, Na+, K+, Rb+ dan Cs+. Ini adalah unsur-unsur golongan IA pada tabel periodik: litium, natrium, kalium, rubidium, dan sesium. Hampir semua senyawa sederhana dari unsur-unsur ini dapat larut.
- Pengecualian: senyawa Li 3 PO 4 tidak larut.
-
Senyawa ion NO 3 -, C 2 H 3 O 2 -, NO 2 -, ClO 3 - dan ClO 4 - dapat larut. Mereka masing-masing disebut ion nitrat, asetat, nitrit, klorat, dan perklorat. Ion asetat sering disingkat OAc.
- Pengecualian: Ag(OAc) (perak asetat) dan Hg(OAc) 2 (merkuri asetat) tidak larut.
- AgNO 2 - dan KClO 4 - hanya “sedikit larut”.
-
Senyawa ion Cl - , Br - dan I - biasanya larut. Ion klorin, brom, dan yodium masing-masing membentuk klorida, borida, dan iodida, yang disebut garam halogen. Garam-garam ini hampir selalu larut.
- Pengecualian: jika ion kedua pada pasangan tersebut adalah ion perak Ag+, merkuri Hg 2 2+ atau timbal Pb 2+, maka garam tersebut tidak larut. Hal yang sama berlaku untuk halogen yang kurang umum dengan ion tembaga Cu+ dan talium Tl+.
-
Senyawa ion SO 4 2- (sulfat) biasanya larut. Umumnya, sulfat larut dalam air, namun ada beberapa pengecualian.
- Pengecualian: sulfat dari ion berikut tidak larut: strontium Sr 2+, barium Ba 2+, timbal Pb 2+, perak Ag +, kalsium Ca 2+, radium Ra 2+ dan perak divalen Hg 2 2+. Perhatikan bahwa perak sulfat dan kalsium sulfat sedikit larut dalam air dan terkadang dianggap sebagai zat yang sedikit larut.
-
Senyawa OH - dan S 2- tidak larut dalam air. Ini masing-masing adalah ion hidroksida dan sulfida.
- Pengecualian: ingat tentang logam alkali (golongan IA) dan fakta bahwa hampir semua senyawanya dapat larut? Jadi, ion Li+, Na+, K+, Rb+ dan Cs+ membentuk hidroksida dan sulfida yang larut. Selain itu, garam kalsium Ca 2+, strontium Sr 2+ dan garam barium Ba 2+ (golongan IIA) dapat larut. Perlu diketahui bahwa sebagian besar molekul hidroksida dari unsur-unsur ini masih belum larut, sehingga terkadang dianggap “sedikit larut”.
-
Senyawa ion CO 3 2- dan PO 4 3- tidak larut. Ion-ion ini membentuk karbonat dan fosfat, yang biasanya tidak larut dalam air.
- Pengecualian: ion-ion ini membentuk senyawa larut dengan ion logam alkali: Li +, Na +, K +, Rb + dan Cs +, serta dengan amonium NH 4 +.
Menggunakan hasil kali kelarutan K sp
-
Temukan produk kelarutan K sp (ini adalah konstanta). Setiap senyawa mempunyai konstanta Ksp masing-masing. Nilai-nilainya untuk berbagai zat diberikan dalam buku referensi dan di situs web (dalam bahasa Inggris). Nilai hasil kali kelarutan ditentukan secara eksperimental dan dapat berbeda secara signifikan satu sama lain di berbagai sumber, jadi sebaiknya gunakan tabel K sp di buku teks kimia Anda, jika tabel seperti itu tersedia. Kecuali disebutkan lain, sebagian besar tabel memberikan hasil kali kelarutan pada 25ºC.
- Misalnya, jika Anda melarutkan timbal iodida PbI 2, carilah hasil kali kelarutannya. Website bilbo.chm.uri.edu memberikan nilai 7.1×10 –9.
-
Tuliskan persamaan kimianya. Pertama, tentukan ion mana yang akan terurai oleh molekul suatu zat ketika dilarutkan. Kemudian tulis persamaan dengan K sp di satu sisi dan ion-ion yang bersesuaian di sisi lain.
- Dalam contoh kita, molekul PbI 2 dipecah menjadi ion Pb 2+ dan dua ion I -. Dalam hal ini, cukup untuk menetapkan muatan satu ion saja, karena larutan keseluruhannya akan netral.
- Tuliskan persamaannya: 7.1×10 –9 = 2.
-
Susun ulang persamaan untuk menyelesaikannya. Tulis ulang persamaan tersebut dalam bentuk aljabar sederhana. Gunakan apa yang Anda ketahui tentang jumlah molekul dan ion. Gantikan jumlah x yang tidak diketahui dengan jumlah atom senyawa larut dan nyatakan jumlah ion dalam x.
- Dalam contoh kita, persamaan berikut perlu ditulis ulang: 7,1 × 10 –9 = 2.
- Karena senyawa hanya mengandung satu atom timbal (Pb), jumlah molekul terlarut akan sama dengan jumlah ion timbal bebas. Jadi, kita bisa menyamakan dan x.
- Karena terdapat dua ion iodium (I) untuk setiap ion timbal, jumlah atom iodium harus sama dengan 2x.
- Persamaan yang dihasilkan adalah 7,1×10 –9 = (x)(2x) 2 .
-
Pertimbangkan ion bersama jika perlu. Lewati langkah ini jika zat tersebut larut dalam air murni. Namun, jika Anda menggunakan larutan yang sudah mengandung satu atau lebih ion yang diinginkan (“ion total”), kelarutannya mungkin berkurang secara signifikan. Pengaruh ion-ion sejenis terutama terlihat pada zat-zat yang sukar larut, dan dalam kasus seperti ini dapat diasumsikan bahwa sebagian besar ion-ion terlarut sudah ada dalam larutan sebelumnya. Tulis ulang persamaan tersebut untuk memasukkan konsentrasi molar yang diketahui (mol per liter, atau M) dari ion-ion yang telah terlarut. Sesuaikan nilai x yang tidak diketahui untuk ion-ion ini.
- Misalnya, jika timbal iodida sudah ada dalam larutan dengan konsentrasi 0,2M, persamaannya harus ditulis ulang sebagai berikut: 7,1×10 –9 = (0,2M+x)(2x) 2 . Karena 0,2M jauh lebih besar dari x, kita dapat menuliskan persamaannya sebagai 7,1×10 –9 = (0,2M)(2x) 2 .
-
Selesaikan persamaannya. Temukan nilai x untuk mengetahui seberapa larut suatu senyawa. Karena definisi hasil kali kelarutan, jawabannya akan dinyatakan dalam mol zat terlarut per liter air. Anda mungkin memerlukan kalkulator untuk menghitung hasil akhirnya.
- Untuk pelarutan dalam air murni, yaitu tanpa adanya ion-ion sejenis, kita mendapatkan:
- 7,1×10 –9 = (x)(2x) 2
- 7,1×10 –9 = (x)(4x 2)
- 7,1×10 –9 = 4x 3
- (7,1×10 –9)/4 = x 3
- x = ∛((7,1×10 –9)/4)
- x = 1,2 x 10 -3 mol per liter air. Jumlahnya sangat kecil, sehingga zat ini praktis tidak larut.
Pelarut yang paling umum di planet kita adalah air. Tubuh orang dengan berat rata-rata 70 kg mengandung kurang lebih 40 kg air. Dalam hal ini, sekitar 25 kg air merupakan cairan di dalam sel, dan 15 kg adalah cairan ekstraseluler, yang meliputi plasma darah, cairan antar sel, cairan serebrospinal, cairan intraokular, dan isi cairan saluran cerna. Pada organisme hewan dan tumbuhan, kandungan air biasanya lebih dari 50%, dan pada beberapa kasus kandungan airnya mencapai 90-95%.
Karena sifatnya yang anomali, air merupakan pelarut unik yang beradaptasi sempurna terhadap kehidupan.
Pertama-tama, air melarutkan senyawa ionik dan banyak senyawa polar dengan baik. Sifat air ini sebagian besar disebabkan oleh konstanta dielektriknya yang tinggi (78,5).
Kelas besar zat lainnya yang sangat larut dalam air mencakup senyawa organik polar seperti gula, aldehida, keton, dan alkohol. Kelarutannya dalam air dijelaskan oleh kecenderungan molekul air untuk membentuk ikatan polar dengan gugus fungsi polar zat tersebut, misalnya dengan gugus hidroksil alkohol dan gula atau dengan atom oksigen dari gugus karbonil aldehida dan keton. Di bawah ini adalah contoh ikatan hidrogen yang penting untuk kelarutan zat dalam sistem biologis. Karena polaritasnya yang tinggi, air menyebabkan hidrolisis zat.
Karena air merupakan bagian utama dari lingkungan internal tubuh, air menjamin proses penyerapan, pergerakan nutrisi dan produk metabolisme dalam tubuh.
Perlu dicatat bahwa air adalah produk akhir dari oksidasi biologis suatu zat, khususnya glukosa. Terbentuknya air akibat proses tersebut disertai dengan pelepasan energi dalam jumlah besar, kira-kira 29 kJ/mol.
Sifat anomali air lainnya juga penting: tegangan permukaan tinggi, viskositas rendah, titik leleh dan titik didih tinggi, dan kepadatan lebih tinggi dalam keadaan cair dibandingkan dalam keadaan padat.
Air dicirikan oleh adanya ikatan kelompok molekul yang dihubungkan oleh ikatan hidrogen.
Tergantung pada afinitasnya terhadap air, gugus fungsi partikel larut dibagi menjadi hidrofilik (menarik air), mudah larut dalam air, hidrofobik (menolak air) dan amfifilik.
KE kelompok hidrofilik termasuk gugus fungsi polar: hidroksil -OH, amino -NH 2, tiol -SH, karboksil -COOH.
KE hidrofobik - kelompok non-polar, misalnya radikal hidrokarbon: CH3-(CH 2) p -, C 6 H 5 -.
Hifilik meliputi zat (asam amino, protein), yang molekulnya mengandung gugus hidrofilik (-OH, -NH 2, -SH, -COOH) dan gugus hidrofobik: (CH 3, (CH 2) n, - dari 6 jam 5 -).
Ketika zat difilik larut, struktur air berubah akibat interaksi dengan gugus hidrofobik. Derajat keteraturan molekul air yang terletak dekat dengan gugus hidrofobik meningkat, dan kontak molekul air dengan gugus hidrofobik diminimalkan. Gugus hidrofobik, bila berasosiasi, mendorong molekul air keluar dari areanya.
Proses pembubaran
Sifat proses pembubarannya rumit. Tentu saja timbul pertanyaan mengapa beberapa zat mudah larut dalam beberapa pelarut dan sulit larut atau praktis tidak larut dalam pelarut lain.
 Pembentukan larutan selalu dikaitkan dengan proses fisika tertentu. Salah satu proses tersebut adalah difusi zat terlarut dan pelarut. Berkat difusi, partikel (molekul, ion) dikeluarkan dari permukaan zat yang larut dan didistribusikan secara merata ke seluruh volume pelarut. Inilah sebabnya, jika tidak ada pengadukan, laju disolusi bergantung pada laju difusi. Namun, tidak mungkin menjelaskan kelarutan zat yang tidak sama dalam pelarut yang berbeda hanya dengan proses fisika.
Pembentukan larutan selalu dikaitkan dengan proses fisika tertentu. Salah satu proses tersebut adalah difusi zat terlarut dan pelarut. Berkat difusi, partikel (molekul, ion) dikeluarkan dari permukaan zat yang larut dan didistribusikan secara merata ke seluruh volume pelarut. Inilah sebabnya, jika tidak ada pengadukan, laju disolusi bergantung pada laju difusi. Namun, tidak mungkin menjelaskan kelarutan zat yang tidak sama dalam pelarut yang berbeda hanya dengan proses fisika.
Ahli kimia besar Rusia D.I. Mendeleev (1834-1907) percaya bahwa proses kimia memainkan peran penting dalam pelarutan. Ia membuktikan adanya hidrat asam sulfat H 2 SO 4 * H 2 O, H 2 SO 4 * 2H 2 O, H 2 SO 4 * 4H 2 O dan beberapa zat lain, misalnya C 2 H 5 OH * 3H 2 O. B Dalam kasus ini, pelarutan disertai dengan pembentukan ikatan kimia antara partikel zat terlarut dan pelarut. Proses ini disebut solvasi, khususnya jika pelarutnya adalah air, maka hidrasi.
Sebagaimana telah ditetapkan, bergantung pada sifat zat terlarut, solvat (hidrat) dapat terbentuk sebagai hasil interaksi fisik: interaksi ion-dipol (misalnya, selama pelarutan zat berstruktur ionik (NaCI, dll. ); interaksi dipol-dipol selama pelarutan zat yang mempunyai struktur molekul (zat organik) ).
Interaksi kimia terjadi karena adanya ikatan donor-akseptor. Di sini, ion terlarut adalah akseptor elektron, dan pelarut (H 2 O, NH 3) adalah donor elektron (misalnya, pembentukan kompleks aqua), serta sebagai hasil pembentukan ikatan hidrogen (misalnya, pelarutan alkohol dalam air).
 Bukti interaksi kimia antara zat terlarut dan pelarut adalah efek termal dan perubahan warna yang menyertai pelarutan.
Bukti interaksi kimia antara zat terlarut dan pelarut adalah efek termal dan perubahan warna yang menyertai pelarutan.
Misalnya, ketika kalium hidroksida dilarutkan dalam air, panas dilepaskan:
KOH + xH 2 O = KOH (H 2 O) x; ΔН° sol = 55 kJ/mol.
Dan ketika natrium klorida larut, panas diserap:
NaCI + xH 2 O = NaCI (H 2 O) x; ΔН° sol = +3,8 kJ/mol.
Kalor yang dilepaskan atau diserap ketika 1 mol suatu zat dilarutkan disebut panas larutan Q larutan
Menurut hukum pertama termodinamika
Solusi Q = solusi ΔН ,
di mana dist adalah perubahan entalpi ketika sejumlah zat dilarutkan.
Melarutkan tembaga sulfat anhidrat putih dalam air menghasilkan munculnya warna biru pekat. Pembentukan solvat, perubahan warna, efek termal, serta sejumlah faktor lainnya menunjukkan perubahan sifat kimia komponen larutan selama pembentukannya.
Jadi, sesuai dengan konsep modern, pelarutan adalah proses fisikokimia di mana jenis interaksi fisik dan kimia berperan.
Kita semua tahu sejak kecil bahwa air adalah pelarut yang sangat baik. Tapi “efek ajaib” apa yang terjadi ketika air ditambahkan ke zat tertentu? Dan mengapa, jika pelarut ini dianggap universal, apakah masih ada zat - “gagak putih” yang tidak akan pernah bisa ditangani oleh air?
Rahasianya sederhana, namun cerdik. Molekul air itu sendiri netral secara listrik. Namun, muatan listrik di dalam molekul terdistribusi sangat tidak merata. Wilayah atom hidrogen memiliki “karakter” positif, dan “tempat tinggal” oksigen terkenal dengan muatan negatifnya yang ekspresif.
Jika energi tarik menarik molekul air terhadap molekul suatu zat lebih besar dibandingkan dengan energi tarik menarik antar molekul air, maka zat tersebut akan larut. Jika syarat ini tidak terpenuhi, maka “keajaiban” juga tidak akan terjadi.
“Lampu lalu lintas” utama dengan lampu merah menyala untuk air adalah lemak. Itu sebabnya, jika kita tiba-tiba “menghadiahi” pakaian kita dengan noda berminyak yang ekspresif, ungkapan “Tambahkan air saja” tidak akan menyelamatkan dalam situasi ini.
Meskipun karena secara tidak sadar kita terbiasa melihat air sebagai pelarut universal yang dapat mengatasi hampir semua masalah, seringkali kita masih mencoba menyelesaikan masalah tersebut dengan bantuan air. Dan ketika kita tidak berhasil, seringkali kita marah, padahal seharusnya kita… bahagia. Ya, bergembiralah!
Memang, karena air tidak memiliki kemampuan untuk melarutkan lemak, kita bisa... hidup. Karena justru karena lemak termasuk dalam “daftar hitam” air yang tidak kita larutkan sendiri.
Tapi garam, basa, dan asam untuk air adalah “kelezatan” yang nyata. Omong-omong, sifat kimia seperti itu sekali lagi sangat berguna bagi manusia. Lagi pula, jika tidak demikian, maka produk pembusukan akan menjadi tempat pembuangan sampah yang nyata di dalam tubuh, dan otomatis darah akan mengental. Oleh karena itu, jika seseorang kekurangan air, ia sudah meninggal pada hari ke-5. Selain itu, tentu saja, jika Anda tidak menerima jumlah yang dibutuhkan secara teratur (norma “rata-rata” adalah 2-3 liter per hari), garam yang tidak larut secara signifikan meningkatkan risiko batu ginjal dan kandung kemih.
Namun, tentu saja, justru karena air melarutkan, misalnya garam yang sama, tidak perlu berubah menjadi “peminum air” yang tidak terkendali, membuat “catatan” yang berani, hanya karena suatu perselisihan mengharuskannya melakukan hal tersebut. Toh, hal ini bisa sangat mengganggu keseimbangan mineral tubuh.
Omong-omong, dengan memahaminya sendiri (baik dalam arti harfiah maupun kiasan) dan memahami esensi fisik dan kimia dari fenomena ini, mudah untuk memahami peran air sebagai pelarut di banyak bidang lain, baik domestik maupun industri. .
Air adalah pelarut
suatu zat cair yang di dalamnya terdapat zat-zat lain yang terlarut suatu zat yang telah larut dalam suatu pelarut Pelarut Terlarut Pelarut yang sangat baik
Kami ingin mengetahuinya. Banyak zat di dalam air yang dapat terurai menjadi partikel-partikel kecil yang tidak terlihat, yaitu larut. Oleh karena itu, air merupakan pelarut yang baik untuk banyak zat. Saya mengusulkan untuk melakukan eksperimen dan mengidentifikasi metode yang memungkinkan untuk memperoleh jawaban atas pertanyaan apakah suatu zat larut dalam air atau tidak. Apa yang kita ambil? Apa yang kita lihat? Garam meja? Gula pasir? Pasir sungai? Tanah liat? Kelarutan bergantung pada apa (percobaan)?
Kelarutan adalah kandungan zat terlarut dalam larutan jenuh. Ada:
Mari kita melakukan percobaan: Isi gelas transparan dengan air matang. Tuangkan satu sendok teh garam meja ke dalamnya. Sambil mengaduk air, amati apa yang terjadi pada kristal garam.
Garam dilarutkan dalam air. Transparansi tidak berubah. Warnanya tidak berubah. Tapi rasanya – ya! Solusinya menjadi asin.
Masukkan corong dengan filter ke dalam gelas kosong dan masukkan air dan garam ke dalamnya. Garam dan air melewati filter; tidak tersisa di filter. Dan rasa setelah disaring sama saja. Jadi dia bubar.
Mari kita melakukan percobaan: Isi gelas transparan dengan air matang. Tuang satu sendok teh gula pasir ke dalamnya. Sambil mengaduk air, amati apa yang terjadi pada kristal gula.
Gula dilarutkan dalam air. Transparansi air tidak berubah. Warnanya tidak berubah. Gula tidak lagi terlihat di dalam air. Tapi rasanya – ya!
Masukkan corong dengan filter ke dalam gelas kosong dan masukkan air dan gula ke dalamnya. Gula dilarutkan dalam air. Itu tidak tertinggal di filter, itu mengalir bersama air. Dan rasa setelah disaring sama saja.
Mari kita lakukan percobaannya: Aduk satu sendok teh pasir sungai ke dalam segelas air. Diamkan campurannya.
Warna airnya berubah, menjadi keruh dan kotor. Butiran pasir besar tergeletak di dasar, butiran kecil mengapung. Pasirnya tidak larut.
Masukkan corong dengan filter ke dalam gelas kosong dan masukkan isinya ke dalamnya. Pasir tetap berada di filter, air melewatinya dan dimurnikan. Filter membantu menjernihkan air dari partikel-partikel yang tidak larut di dalamnya.
Mari kita lakukan percobaannya: Aduk satu sendok teh tanah liat ke dalam segelas air. Diamkan campurannya.
Tanah liat belum larut dalam air, air keruh, partikel tanah liat berukuran besar jatuh ke dasar, dan partikel kecil terapung di air.
Masukkan isi gelas melalui kertas saring. Air melewati filter, dan partikel yang tidak larut tetap berada di filter. Filter membantu membersihkan air dari partikel-partikel yang tidak larut dalam air.
Lembaga Pendidikan Negeri Wilayah Tula “Pusat Pendidikan Daerah Tula” (Jurusan Pendidikan Umum yang Disesuaikan untuk Siswa Penyandang Disabilitas Intelektual No. 1)
Topik: Kemampuan air untuk melarutkan padatan (garam, gula, dll). Zat larut dan tidak larut. Solusi rumah tangga (mencuci, minum, dll). Solusi di alam: mineral, air laut.
Biologi kelas 6. Pelatihan individu.
Sebuah pelajaran dalam memperoleh pengetahuan baru.
Guru: Kurbatova N.S.
Tujuan pelajaran: mengembangkan pengetahuan di bidang sifat-sifat air, khususnya kemampuan air dalam melarutkan zat; memperluas pemahaman siswa tentang solusi dalam kehidupan sehari-hari dan alam serta kegunaannya.
Tugas:
Pendidikan:
- ulangi sifat-sifat air yang telah dipelajari sebelumnya;
- mengenalkan siswa pada kemampuan air untuk melarutkan zat tertentu;
- memperkenalkan seorang siswa dengan solusi dalam kehidupan sehari-hari dan alam serta pemanfaatannya;
- belajar menentukan kesesuaian air untuk minum dan memasak.
Pendidik:
- menumbuhkan sikap terhadap air sebagai sumber daya alam yang penting;
- mengembangkan keterampilan merawat alam.
Perbaikan:
- mengembangkan keterampilan observasi dan perbandingan saat melakukan kerja praktek;
- pengembangan keterampilan berbicara yang benar (konstruksi kalimat umum yang lengkap saat menjawab pertanyaan guru);
- perluasan kosa kata;
- koreksi pemikiran logis berdasarkan analisis dan penetapan pola;
- pengembangan perhatian sukarela.
Peralatan:
1. Gelas plastik;
2. Sendok plastik;
3. Kertas saring;
4. Tanah liat, garam;
5. Komputer, file dengan presentasi.
Kemajuan pelajaran
1. Momen organisasi.
Salam. Komunikasikan topik dan tujuan pelajaran.
Geser 2. (Gambar air di alam di berbagai negara bagian.)
- Apa yang terlihat di foto? (kabut, sungai, salju, es, awan)
- Apa persamaan dari foto-foto tersebut? (Air di berbagai negara bagian.)
- Air memiliki kemampuan unik. Itu bisa dalam bentuk cair, padat, atau gas.
Hari ini kita terus mempelajari sifat-sifat air.
2.
Pengulangan.
Slide 3-8. Sifat-sifat air.
- Anda sudah mengetahui beberapa sifat air.
- Perhatikan diagram dan rumuskan. Slide 5-11.
(Tidak memiliki warna, bentuk, rasa atau bau, transparan, cair.)
3. Mempelajari materi baru.
Dalam pelajaran ini Anda akan belajar tentang sifat lain air. Untuk melakukan ini, mari kita lakukan percobaan.
Kerja praktek.
Slide 9-10. Pengalaman No1.
- Mari kita mulai eksperimennya. Tuangkan air ke dalam gelas.
- Apa warna air di dalam gelas? (Tidak berwarna, transparan).
- Tambahkan sedikit garam ke dalam segelas air. Perhatikan apa yang terjadi.
- Seperti apa airnya? (Berawan, lalu tidak berwarna).
- Apakah butiran garam terlihat di dalam air? (TIDAK)
-Apakah mereka menghilang?
- Air melarutkan garam sepenuhnya.
- Sebagai hasil percobaan, kami memperoleh zat yang diperlukan manusia - larutan garam. Katakan padaku, bagaimana orang menggunakan larutan garam?
Geser 11. Pengalaman No2.
- Sekarang tambahkan tanah liat ke dalam segelas air bersih. Mengaduk.
- Apa yang kamu lihat? Apa warna airnya? (berawan, buram)
- Tanah liat tidak larut sempurna dalam air. Beberapa padatan mengendap di dasar gelas.
Tidak semua zat larut dalam air. Kaca, perak, emas merupakan zat (padatan) yang praktis tidak larut dalam air. Ini juga termasuk minyak tanah, minyak sayur (cairan), dan beberapa gas.
- Contoh zat terlarut: garam meja, gula, soda, jus ceri, pati.
Buatlah sebuah kata dari kartu-kartu tersebut dan sebutkan sifat-sifat air yang Anda kenal.(Pelarut)
Air merupakan pelarut yang baik untuk banyak zat padat.Tidak semua zat larut dalam air.Geser 12.
Pendidikan Jasmani.
Sekali lagi kami mengadakan sesi pendidikan jasmani,
Ayo membungkuk, ayo, ayo!
Diluruskan, diregangkan,
Dan sekarang mereka sudah berusaha sekuat tenaga.
Meskipun biayanya singkat,
Kami beristirahat sebentar.
Slide 13-14. Pengalaman No3. Pemurnian air.
- Air menjadi kotor.
- Air kotor (air yang mempunyai warna atau bau asing) tidak boleh dikonsumsi sebagai makanan. Mengapa? (Dapat membahayakan tubuh.)
- Menurut Anda apakah air keruh bisa dibersihkan dari partikel pasir dan tanah liat?
- Bagaimana ini bisa dilakukan? (Gunakan penyaring.)
- Filter adalah alat untuk menjernihkan air.
Pertimbangan filter rumah tangga. Geser 13.
- Kami akan membuat filter dari kertas khusus. Potong sebuah lingkaran. Buatlah potongan dari tepi ke tengah. Lipat menjadi kerucut.
- Ambil gelas kosong. Masukkan kerucut kertas saring ke dalamnya.
- Tuangkan air yang terkontaminasi ke dalam gelas melalui kerucut kertas saring. Perhatikan apa yang terjadi. (Air bersih menetes ke dalam gelas. Partikel padat tertinggal di filter.)
- Apakah air yang dihasilkan mempunyai warna? Apakah transparan? (Melihat benda di balik kaca.)
- Hasilnya air jernih. Kami telah membuat filter sederhana. Proses pemurnian air disebut filtrasi.
Cobalah mengalirkan air garam melalui filter. Ulangi langkah yang sama seperti saat menyaring air yang mengandung tanah liat. (Siswa membuat filter baru. Memasukkannya ke dalam gelas bersih. Menuangkan larutan garam melalui filter.)
Perhatikan apa yang terjadi. Apakah masih ada partikel garam yang tertinggal di filter?
Garam yang larut dalam air menjadi tidak terlihat dan ikut melewati filter. Tidak mungkin memurnikan air dari zat terlarut menggunakan filter.
Geser 15.
Agar tetap sehat, kita harus minum air bersih. Untuk memurnikan air, orang menciptakan perangkat dengan kompleksitas yang berbeda-beda.
Bagaimana air dimurnikan di alam?
- Pasir memainkan peran utama dalam memurnikan air dari banyak kotoran. (Contohnya adalah musim semi.)
Air di alam selalu mengandung berbagai zat terlarut. Oleh karena itu, ingatlah bahwa tidak semua air layak untuk diminum. Jika Anda tidak tahu apakah suatu sumber air bersih, Anda tidak dapat meminum air dari sumber tersebut.
4. Dimasukkannya materi baru ke dalam sistem pengetahuan.
Solusi di alam dan di rumah.Slide 16-19.
Air adalah pelarut yang sangat baik. Itu bisa melarutkan hampir semua hal. Bahkan beberapa logam. Misalnya perak bisa larut dalam air. Solusi ini digunakan untuk mengobati penyakit dan luka gastrointestinal. Air yang melarutkan garam mineral disebut air mineral. Air ini membantu menyembuhkan banyak penyakit. Di tempat di mana mata air mineral berada, sanatorium dibangun. Contoh lain larutan garam alami adalah air laut. Berbeda dengan air tawar dan air mineral, air ini tidak cocok untuk diminum. Tidak semua larutan air sehat dan layak dikonsumsi. Mereka punya tujuan lain.
- Bagaimana kita menggunakan kemampuan air untuk melarutkan zat? (Melihat foto. Percakapan.)