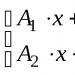Ikatan kovalen adalah jenis ikatan kimia yang paling umum, terjadi melalui interaksi dengan nilai keelektronegatifan yang sama atau serupa.
Ikatan kovalen adalah ikatan antar atom yang menggunakan pasangan elektron bersama.
Setelah penemuan elektron, banyak upaya dilakukan untuk mengembangkan teori elektronik tentang ikatan kimia. Yang paling sukses adalah karya Lewis (1916), yang mengusulkan untuk mempertimbangkan pembentukan ikatan sebagai konsekuensi dari munculnya pasangan elektron yang sama pada dua atom. Untuk melakukan ini, setiap atom menyumbangkan jumlah elektron yang sama dan mencoba mengelilingi dirinya dengan oktet atau doublet elektron yang merupakan karakteristik konfigurasi elektron terluar gas mulia. Secara grafis, pembentukan ikatan kovalen akibat elektron tidak berpasangan menurut metode Lewis digambarkan dengan titik-titik yang menunjukkan elektron terluar atom.
Pembentukan ikatan kovalen menurut teori Lewis
Mekanisme pembentukan ikatan kovalen
Ciri utama ikatan kovalen adalah adanya pasangan elektron yang sama milik kedua atom yang terhubung secara kimia, karena kehadiran dua elektron di medan aksi dua inti secara energetik lebih menguntungkan daripada kehadiran setiap elektron di medan. intinya sendiri. Pembentukan pasangan ikatan elektron yang sama dapat terjadi melalui mekanisme yang berbeda, paling sering melalui pertukaran, dan terkadang melalui mekanisme donor-akseptor.
Menurut prinsip mekanisme pertukaran pembentukan ikatan kovalen, masing-masing atom yang berinteraksi menyuplai jumlah elektron yang sama dengan spin antiparalel untuk membentuk ikatan. Misalnya:
 Skema umum pembentukan ikatan kovalen: a) menurut mekanisme pertukaran; b) menurut mekanisme donor-akseptor
Skema umum pembentukan ikatan kovalen: a) menurut mekanisme pertukaran; b) menurut mekanisme donor-akseptor Menurut mekanisme donor-akseptor, ikatan dua elektron terjadi ketika partikel berbeda berinteraksi. Salah satunya adalah donatur A: mempunyai pasangan elektron yang tidak dipakai bersama (yaitu, elektron yang dimiliki hanya oleh satu atom), dan elektron lainnya merupakan akseptor DI DALAM— memiliki orbital kosong.
Partikel yang menyediakan dua elektron (pasangan elektron tidak berbagi) untuk berikatan disebut donor, dan partikel dengan orbital kosong yang menerima pasangan elektron ini disebut akseptor.
Mekanisme pembentukan ikatan kovalen akibat awan dua elektron suatu atom dan orbital kosong atom lain disebut mekanisme donor-akseptor.
Ikatan donor-akseptor disebut semipolar, karena muatan positif efektif parsial δ+ muncul pada atom donor (karena pasangan elektron yang tidak terbagi telah menyimpang darinya), dan muatan negatif efektif parsial δ- muncul di atom akseptor (karena , ada pergeseran arahnya terhadap pasangan elektron donor yang tidak terbagi).
Contoh donor pasangan elektron sederhana adalah ion H — , yang memiliki pasangan elektron yang tidak terbagi. Akibat penambahan ion hidrida negatif pada molekul yang atom pusatnya memiliki orbital bebas (ditunjukkan dalam diagram sebagai sel kuantum kosong), misalnya BH 3, terbentuk ion kompleks kompleks BH 4 — dengan muatan negatif (N — + VN 3 ⟶⟶ [VN 4 ] -) :

Akseptor pasangan elektron adalah ion hidrogen, atau sederhananya proton H+. Penambahannya pada molekul yang atom pusatnya memiliki pasangan elektron tidak terbagi, misalnya pada NH 3, juga mengarah pada pembentukan ion kompleks NH 4 +, tetapi bermuatan positif:

Metode ikatan valensi
Pertama teori mekanika kuantum ikatan kovalen diciptakan oleh Heitler dan London (pada tahun 1927) untuk mendeskripsikan molekul hidrogen, dan kemudian diterapkan oleh Pauling pada molekul poliatomik. Teori ini disebut metode ikatan valensi, ketentuan pokoknya dapat diringkas secara singkat sebagai berikut:
- setiap pasangan atom dalam suatu molekul disatukan oleh satu atau lebih pasangan elektron bersama, dengan orbital elektron dari atom yang berinteraksi saling tumpang tindih;
- kekuatan ikatan tergantung pada tingkat tumpang tindih orbital elektron;
- syarat terbentuknya ikatan kovalen adalah antiarah putaran elektron; Oleh karena itu, orbital elektron umum dengan kerapatan elektron tertinggi di ruang antar inti muncul, yang memastikan tarikan inti bermuatan positif satu sama lain dan disertai dengan penurunan energi total sistem.
Hibridisasi orbital atom
Terlepas dari kenyataan bahwa elektron dari orbital s-, p- atau d, yang memiliki bentuk berbeda dan orientasi berbeda dalam ruang, berpartisipasi dalam pembentukan ikatan kovalen, dalam banyak senyawa ikatan ini ternyata setara. Untuk menjelaskan fenomena ini, konsep “hibridisasi” diperkenalkan.
Hibridisasi adalah proses pencampuran dan penyelarasan orbital dalam bentuk dan energi, di mana kerapatan elektron dari orbital yang energinya dekat didistribusikan kembali, sehingga menjadi setara.
Ketentuan pokok teori hibridisasi:
- Selama hibridisasi, bentuk awal dan orbital saling berubah, dan orbital hibridisasi baru terbentuk, tetapi dengan energi dan bentuk yang sama, mengingatkan pada angka delapan yang tidak beraturan.
- Jumlah orbital hibridisasi sama dengan jumlah orbital keluaran yang terlibat dalam hibridisasi.
- Orbital dengan energi serupa (orbital s dan p pada tingkat energi terluar dan orbital d pada tingkat energi terluar atau awal) dapat berpartisipasi dalam hibridisasi.
- Orbital hibridisasi lebih memanjang ke arah pembentukan ikatan kimia dan oleh karena itu memberikan tumpang tindih yang lebih baik dengan orbital atom tetangga, sehingga menjadi lebih kuat daripada yang dibentuk oleh elektron dari masing-masing orbital non-hibrid.
- Karena pembentukan ikatan yang lebih kuat dan distribusi kerapatan elektron yang lebih simetris dalam molekul, diperoleh perolehan energi, yang lebih dari sekadar mengkompensasi konsumsi energi yang diperlukan untuk proses hibridisasi.
- Orbital hibridisasi harus diorientasikan dalam ruang sedemikian rupa untuk memastikan jarak maksimum satu sama lain; dalam hal ini energi tolakan minimal.
- Jenis hibridisasi ditentukan oleh jenis dan jumlah orbital keluar serta perubahan besar sudut ikatan serta konfigurasi spasial molekul.
 Bentuk orbital hibridisasi dan sudut ikatan (sudut geometris antara sumbu simetri orbital) tergantung pada jenis hibridisasi: a) hibridisasi sp; b) hibridisasi sp2; c) hibridisasi sp3
Bentuk orbital hibridisasi dan sudut ikatan (sudut geometris antara sumbu simetri orbital) tergantung pada jenis hibridisasi: a) hibridisasi sp; b) hibridisasi sp2; c) hibridisasi sp3 Saat membentuk molekul (atau fragmen molekul individu), jenis hibridisasi berikut paling sering terjadi:
 Skema umum hibridisasi sp
Skema umum hibridisasi sp Ikatan yang terbentuk dengan partisipasi elektron dari orbital hibridisasi sp juga ditempatkan pada sudut 180 0, yang menghasilkan bentuk molekul linier. Jenis hibridisasi ini diamati pada halida unsur golongan kedua (Be, Zn, Cd, Hg), yang atomnya dalam keadaan valensi memiliki elektron s dan p yang tidak berpasangan. Bentuk linier juga merupakan ciri molekul unsur lain (0=C=0,HC≡CH), yang ikatannya dibentuk oleh atom hibridisasi sp.
 Skema hibridisasi sp 2 orbital atom dan bentuk molekul segitiga datar, yang disebabkan oleh hibridisasi orbital atom sp 2
Skema hibridisasi sp 2 orbital atom dan bentuk molekul segitiga datar, yang disebabkan oleh hibridisasi orbital atom sp 2 Jenis hibridisasi ini paling khas untuk molekul unsur p golongan ketiga, yang atomnya dalam keadaan tereksitasi memiliki struktur elektronik eksternal ns 1 np 2, di mana n adalah jumlah periode di mana unsur tersebut berada. . Jadi, dalam molekul BF 3, BCl 3, AlF 3 dan ikatan lainnya terbentuk karena orbital hibridisasi sp 2 dari atom pusat.
 Skema hibridisasi orbital atom sp 3
Skema hibridisasi orbital atom sp 3 Menempatkan orbital hibridisasi atom pusat pada sudut 109 0 28` menyebabkan molekul berbentuk tetrahedral. Hal ini sangat khas untuk senyawa jenuh karbon tetravalen CH 4, CCl 4, C 2 H 6 dan alkana lainnya. Contoh senyawa unsur lain yang berstruktur tetrahedral akibat hibridisasi sp 3 orbital valensi atom pusat adalah ion berikut: BH 4 -, BF 4 -, PO 4 3-, SO 4 2-, FeCl 4 - .
 Skema umum hibridisasi sp 3d
Skema umum hibridisasi sp 3d Jenis hibridisasi ini paling sering ditemukan pada halida bukan logam. Contohnya adalah struktur fosfor klorida PCl 5, selama pembentukannya atom fosfor (P...3s 2 3p 3) pertama-tama masuk ke keadaan tereksitasi (P...3s 1 3p 3 3d 1), dan kemudian mengalami hibridisasi s 1 p 3 d - lima orbital satu elektron menjadi setara dan berorientasi dengan ujung memanjang menuju sudut bipiramida trigonal mental. Hal ini menentukan bentuk molekul PCl 5, yang dibentuk oleh tumpang tindih lima orbital hibridisasi s 1 p 3 d dengan orbital 3p dari lima atom klor.
- sp - Hibridisasi. Ketika satu orbital s-i dan satu orbital p digabungkan, muncul dua orbital hibridisasi sp yang terletak simetris pada sudut 180 0.
- sp 2 - Hibridisasi. Kombinasi satu orbital s dan dua orbital p menyebabkan terbentuknya ikatan hibridisasi sp 2 yang terletak pada sudut 120 0, sehingga molekulnya berbentuk segitiga beraturan.
- sp 3 - Hibridisasi. Kombinasi empat orbital - satu s- dan tiga p - mengarah ke sp 3 - hibridisasi, di mana empat orbital hibridisasi berorientasi simetris dalam ruang ke empat simpul tetrahedron, yaitu pada sudut 109 0 28 ` .
- sp 3 d - Hibridisasi. Kombinasi satu orbital s-, tiga p- dan satu d menghasilkan hibridisasi sp 3 d, yang menentukan orientasi spasial dari lima orbital terhibridisasi sp 3 d ke simpul bipiramida trigonal.
- Jenis hibridisasi lainnya. Dalam kasus hibridisasi sp 3 d 2, enam orbital hibridisasi sp 3 d 2 diarahkan ke simpul oktahedron. Orientasi tujuh orbital ke simpul bipiramida pentagonal berhubungan dengan hibridisasi sp 3 d 3 (atau kadang-kadang sp 3 d 2 f) orbital valensi atom pusat molekul atau kompleks.
Metode hibridisasi orbital atom menjelaskan struktur geometri sejumlah besar molekul, namun menurut data eksperimen, molekul dengan sudut ikatan yang sedikit berbeda lebih sering diamati. Misalnya, dalam molekul CH 4, NH 3 dan H 2 O, atom pusat berada dalam keadaan hibridisasi sp 3, sehingga sudut ikatan di dalamnya diperkirakan adalah tetrahedral (~ 109,5 0). Secara eksperimental telah ditetapkan bahwa sudut ikatan dalam molekul CH 4 sebenarnya adalah 109,5 0. Namun, pada molekul NH 3 dan H 2 O, nilai sudut ikatan menyimpang dari sudut tetrahedral: sebesar 107,3 0 pada molekul NH 3 dan 104,5 0 pada molekul H 2 O dijelaskan oleh adanya pasangan elektron yang tidak terbagi pada atom nitrogen dan oksigen. Orbital dua elektron, yang berisi pasangan elektron yang tidak berbagi, karena kepadatannya yang meningkat menolak orbital valensi satu elektron, yang menyebabkan penurunan sudut ikatan. Untuk atom nitrogen dalam molekul NH 3, dari empat orbital hibridisasi sp 3, tiga orbital satu elektron membentuk ikatan dengan tiga atom H, dan orbital keempat berisi pasangan elektron yang tidak berbagi.
Pasangan elektron tak terikat yang menempati salah satu orbital hibridisasi sp 3 yang diarahkan ke simpul tetrahedron, menolak orbital satu elektron, menyebabkan distribusi kerapatan elektron yang asimetris di sekitar atom nitrogen dan, sebagai akibatnya, menekan ikatan. sudut ke 107,3 0. Gambaran serupa tentang penurunan sudut ikatan dari 109,5 0 menjadi 107 0 sebagai akibat dari aksi pasangan elektron atom N yang tidak terbagi diamati pada molekul NCl 3.
 Penyimpangan sudut ikatan dari tetrahedral (109,5 0) pada molekul: a) NH3; b) NCl3
Penyimpangan sudut ikatan dari tetrahedral (109,5 0) pada molekul: a) NH3; b) NCl3 Atom oksigen dalam molekul H 2 O memiliki dua orbital satu elektron dan dua orbital dua elektron per empat orbital hibridisasi sp 3. Orbital hibridisasi satu elektron berpartisipasi dalam pembentukan dua ikatan dengan dua atom H, dan dua pasangan dua elektron tetap tidak terbagi, yaitu hanya dimiliki oleh atom H. Hal ini meningkatkan asimetri distribusi kerapatan elektron di sekitar atom O dan mengurangi sudut ikatan dibandingkan dengan tetrahedral menjadi 104,5 0.
Akibatnya, jumlah pasangan elektron tak terikat pada atom pusat dan penempatannya pada orbital hibridisasi mempengaruhi konfigurasi geometri molekul.
Ciri-ciri ikatan kovalen
Ikatan kovalen memiliki seperangkat sifat spesifik yang menentukan ciri atau karakteristik spesifiknya. Hal ini, selain karakteristik “energi ikatan” dan “panjang ikatan” yang telah dibahas, meliputi: sudut ikatan, saturasi, arah, polaritas, dan sejenisnya.
1. Sudut ikatan- ini adalah sudut antara sumbu ikatan yang berdekatan (yaitu, garis konvensional yang ditarik melalui inti atom yang terhubung secara kimia dalam suatu molekul). Besarnya sudut ikatan bergantung pada sifat orbital, jenis hibridisasi atom pusat, dan pengaruh pasangan elektron tidak berbagi yang tidak ikut serta dalam pembentukan ikatan.
2. Saturasi. Atom mempunyai kemampuan untuk membentuk ikatan kovalen, yang dapat dibentuk, pertama, melalui mekanisme pertukaran akibat elektron tidak berpasangan dari atom yang tidak tereksitasi dan karena elektron tidak berpasangan yang timbul akibat eksitasinya, dan kedua, oleh donor. -mekanisme akseptor. Namun, jumlah ikatan yang dapat dibentuk oleh suatu atom terbatas.
Saturasi adalah kemampuan atom suatu unsur untuk membentuk ikatan kovalen tertentu dengan atom lain dalam jumlah terbatas.
Jadi, periode kedua, yang memiliki empat orbital pada tingkat energi eksternal (satu s- dan tiga p-), membentuk ikatan, yang jumlahnya tidak melebihi empat. Atom unsur periode lain dengan jumlah orbital terluar lebih banyak dapat membentuk lebih banyak ikatan.
3. Fokus. Menurut metode ini, ikatan kimia antar atom disebabkan oleh tumpang tindih orbital, yang kecuali orbital s, memiliki orientasi tertentu dalam ruang, yang mengarah pada arah ikatan kovalen.
Arah ikatan kovalen adalah susunan kerapatan elektron antar atom, yang ditentukan oleh orientasi spasial orbital valensi dan memastikan tumpang tindih maksimumnya.
Karena orbital elektron memiliki bentuk yang berbeda dan orientasi yang berbeda dalam ruang, tumpang tindihnya dapat diwujudkan dengan cara yang berbeda. Tergantung pada ini, ikatan σ-, π- dan δ dibedakan.
Ikatan sigma (ikatan σ) adalah tumpang tindih orbital elektron sehingga kerapatan elektron maksimum terkonsentrasi di sepanjang garis imajiner yang menghubungkan kedua inti.
Ikatan sigma dapat dibentuk oleh dua elektron s, satu elektron s dan satu elektron p, dua elektron p, atau dua elektron d. Ikatan seperti itu dicirikan oleh adanya satu daerah tumpang tindih orbital elektron; ikatan tersebut selalu tunggal, yaitu hanya dibentuk oleh satu pasangan elektron.

Keragaman bentuk orientasi spasial orbital “murni” dan orbital hibridisasi tidak selalu memungkinkan adanya kemungkinan tumpang tindih orbital pada sumbu ikatan. Tumpang tindih orbital valensi dapat terjadi pada kedua sisi sumbu ikatan—yang disebut tumpang tindih “lateral”, yang paling sering terjadi selama pembentukan ikatan π.
Ikatan pi (ikatan π) adalah tumpang tindih orbital elektron dimana kerapatan elektron maksimum terkonsentrasi pada kedua sisi garis yang menghubungkan inti atom (yaitu sumbu ikatan).
Ikatan pi dapat terbentuk melalui interaksi dua orbital p sejajar, dua orbital d, atau kombinasi orbital lain yang sumbunya tidak berimpit dengan sumbu ikatan.
 Skema pembentukan ikatan π antara atom bersyarat A dan B dengan tumpang tindih lateral orbital elektron
Skema pembentukan ikatan π antara atom bersyarat A dan B dengan tumpang tindih lateral orbital elektron 4. Multiplisitas. Karakteristik ini ditentukan oleh jumlah pasangan elektron bersama yang menghubungkan atom. Ikatan kovalen dapat bersifat tunggal (single), rangkap dua, atau rangkap tiga. Ikatan antara dua atom yang menggunakan satu pasangan elektron bersama disebut ikatan tunggal, dua pasangan elektron disebut ikatan rangkap, dan tiga pasangan elektron disebut ikatan rangkap tiga. Jadi, dalam molekul hidrogen H 2 atom-atomnya dihubungkan oleh ikatan tunggal (H-H), dalam molekul oksigen O 2 - oleh ikatan rangkap (B = O), dalam molekul nitrogen N 2 - oleh ikatan rangkap tiga (N ≡N). Banyaknya ikatan sangat penting dalam senyawa organik - hidrokarbon dan turunannya: pada etana C 2 H 6 terdapat ikatan tunggal (C-C) antara atom C, pada etilen C 2 H 4 terdapat ikatan rangkap (C = C) dalam asetilena C 2 H 2 - rangkap tiga (C ≡ C)(C≡C).
Multiplisitas ikatan mempengaruhi energi: seiring dengan peningkatan multiplisitas, kekuatannya meningkat. Peningkatan multiplisitas menyebabkan penurunan jarak antar inti (panjang ikatan) dan peningkatan energi ikat.
 Multiplisitas ikatan antar atom karbon: a) ikatan tunggal pada etana H3C-CH3; b) ikatan rangkap σ+π pada etilen H2C = CH2; c) ikatan rangkap tiga σ+π+π pada asetilena HC≡CH
Multiplisitas ikatan antar atom karbon: a) ikatan tunggal pada etana H3C-CH3; b) ikatan rangkap σ+π pada etilen H2C = CH2; c) ikatan rangkap tiga σ+π+π pada asetilena HC≡CH 5. Polaritas dan polarisasi. Kerapatan elektron ikatan kovalen dapat ditempatkan secara berbeda di ruang antar inti.
Polaritas adalah sifat ikatan kovalen, yang ditentukan oleh lokasi kerapatan elektron di ruang antar inti relatif terhadap atom yang terhubung.
Tergantung pada lokasi kerapatan elektron di ruang antar inti, ikatan kovalen polar dan nonpolar dibedakan. Ikatan nonpolar adalah ikatan di mana awan elektron bersama terletak secara simetris terhadap inti atom yang terhubung dan dimiliki secara setara oleh kedua atom.
Molekul dengan jenis ikatan ini disebut nonpolar atau homonuklear (yaitu molekul yang mengandung atom dari unsur yang sama). Ikatan nonpolar biasanya muncul dalam molekul homonuklir (H 2 , Cl 2 , N 2 , dll.) atau, lebih jarang, dalam senyawa yang dibentuk oleh atom unsur dengan nilai elektronegativitas serupa, misalnya karborundum SiC. Polar (atau heteropolar) adalah ikatan di mana keseluruhan awan elektron tidak simetris dan bergeser ke arah salah satu atom.
Molekul dengan ikatan polar disebut polar, atau heteronuklear. Dalam molekul dengan ikatan polar, pasangan elektron umum digeser ke arah atom dengan elektronegativitas lebih tinggi. Akibatnya, muncul muatan parsial negatif (δ-) pada atom ini, yang disebut efektif, dan atom dengan elektronegativitas lebih rendah memiliki muatan parsial positif (δ+) dengan besaran yang sama, tetapi tandanya berlawanan. Misalnya, secara eksperimental telah ditetapkan bahwa muatan efektif pada atom hidrogen dalam molekul hidrogen klorida HCl adalah δH=+0,17, dan pada atom klor δCl=-0,17 dari muatan elektron absolut.
Untuk menentukan ke arah mana kerapatan elektron ikatan kovalen polar akan bergeser, perlu dilakukan perbandingan elektron kedua atom. Untuk meningkatkan keelektronegatifan, unsur-unsur kimia yang paling umum ditempatkan dalam urutan berikut:
Molekul polar disebut dipol — sistem di mana pusat gravitasi muatan positif inti dan muatan negatif elektron tidak bertepatan.
Dipol adalah suatu sistem yang merupakan gabungan dua muatan listrik titik, yang besarnya sama dan berlawanan tanda, terletak pada jarak tertentu satu sama lain.
Jarak antara pusat tarik-menarik disebut panjang dipol dan dilambangkan dengan huruf l. Polaritas suatu molekul (atau ikatan) secara kuantitatif dicirikan oleh momen dipol μ, yang dalam kasus molekul diatomik sama dengan hasil kali panjang dipol dan muatan elektron: μ=el.
Dalam satuan SI, momen dipol diukur dalam [C × m] (Coulomb meter), tetapi satuan ekstrasistemik [D] (debye) lebih sering digunakan: 1D = 3,33 · 10 -30 C × m momen dipol molekul kovalen bervariasi dalam kisaran 0-4 D, dan ionik - 4-11 D. Semakin panjang dipolnya, semakin polar molekulnya.
Awan elektron bersama dalam suatu molekul dapat dipindahkan karena pengaruh medan listrik eksternal, termasuk medan molekul atau ion lain.
Polarisabilitas adalah perubahan polaritas suatu ikatan sebagai akibat perpindahan elektron-elektron pembentuk ikatan akibat pengaruh medan listrik luar, termasuk medan gaya partikel lain.
Polarisasi suatu molekul bergantung pada mobilitas elektron, yang semakin kuat semakin besar jarak dari inti. Selain itu, polarisasi bergantung pada arah medan listrik dan kemampuan awan elektron untuk berubah bentuk. Di bawah pengaruh medan luar, molekul non-polar menjadi polar, dan molekul polar menjadi lebih polar, yaitu dipol diinduksi dalam molekul, yang disebut dipol tereduksi atau terinduksi.
 Skema pembentukan dipol terinduksi (tereduksi) dari molekul non-polar di bawah pengaruh medan gaya partikel polar - dipol
Skema pembentukan dipol terinduksi (tereduksi) dari molekul non-polar di bawah pengaruh medan gaya partikel polar - dipol Berbeda dengan dipol permanen, dipol yang diinduksi hanya muncul di bawah pengaruh medan listrik eksternal. Polarisasi tidak hanya menyebabkan polarisasi suatu ikatan, tetapi juga putusnya ikatan tersebut, di mana terjadi transfer pasangan elektron penghubung ke salah satu atom dan terbentuk ion bermuatan negatif dan positif.
Polaritas dan polarisasi ikatan kovalen menentukan reaktivitas molekul terhadap reagen polar.
Sifat-sifat senyawa yang mempunyai ikatan kovalen
Zat dengan ikatan kovalen dibagi menjadi dua kelompok yang tidak sama: molekuler dan atom (atau non-molekuler), yang jumlahnya jauh lebih sedikit daripada zat molekuler.
Senyawa molekul dalam kondisi normal dapat berada dalam berbagai keadaan agregasi: dalam bentuk gas (CO 2, NH 3, CH 4, Cl 2, O 2, NH 3), cairan yang sangat mudah menguap (Br 2, H 2 O, C 2 H 5 OH ) atau zat kristal padat, yang sebagian besar, walaupun dengan sedikit pemanasan, dapat dengan cepat meleleh dan mudah menyublim (S 8, P 4, I 2, gula C 12 H 22 O 11, “es kering” CO 2 ).
Rendahnya titik leleh, sublimasi, dan titik didih zat molekuler dijelaskan oleh sangat lemahnya gaya interaksi antarmolekul dalam kristal. Itulah sebabnya kristal molekuler tidak memiliki ciri kekuatan, kekerasan, dan konduktivitas listrik yang tinggi (es atau gula). Dalam hal ini, zat dengan molekul polar memiliki titik leleh dan titik didih yang lebih tinggi dibandingkan zat nonpolar. Beberapa di antaranya larut dalam atau pelarut polar lainnya. Sebaliknya, zat dengan molekul non-polar larut lebih baik dalam pelarut non-polar (benzena, karbon tetraklorida). Jadi, yodium, yang molekulnya non-polar, tidak larut dalam air polar, tetapi larut dalam CCl 4 non-polar dan alkohol rendah polar.
Zat nonmolekul (atom) dengan ikatan kovalen (berlian, grafit, silikon Si, kuarsa SiO 2, karborundum SiC dan lain-lain) membentuk kristal yang sangat kuat, kecuali grafit, yang memiliki struktur berlapis. Misalnya, kisi kristal intan adalah kerangka tiga dimensi beraturan di mana setiap atom karbon terhibridisasi sp 3 dihubungkan ke empat atom tetangganya dengan ikatan σ. Faktanya, seluruh kristal berlian adalah satu molekul yang besar dan sangat kuat. Kristal silikon, yang banyak digunakan dalam elektronik radio dan teknik elektronik, memiliki struktur serupa. Jika Anda mengganti setengah atom C dalam berlian dengan atom Si tanpa mengganggu struktur kerangka kristal, Anda akan mendapatkan kristal karborundum - silikon karbida SiC - zat yang sangat keras yang digunakan sebagai bahan abrasif. Dan jika atom O disisipkan di dalam kisi kristal silikon di antara setiap dua atom Si, maka terbentuklah struktur kristal kuarsa SiO 2 - juga zat yang sangat keras, yang beragam juga digunakan sebagai bahan abrasif.
Kristal berlian, silikon, kuarsa dan struktur serupa adalah kristal atom; mereka adalah “supermolekul” yang sangat besar, sehingga rumus strukturnya tidak dapat digambarkan secara lengkap, tetapi hanya dalam bentuk fragmen terpisah, misalnya:
 Kristal berlian, silikon, kuarsa
Kristal berlian, silikon, kuarsa Kristal non-molekul (atom), terdiri dari atom-atom dari satu atau dua unsur yang dihubungkan oleh ikatan kimia, diklasifikasikan sebagai zat tahan api. Temperatur leleh yang tinggi disebabkan oleh kebutuhan untuk mengeluarkan sejumlah besar energi untuk memutus ikatan kimia yang kuat ketika kristal atom dicairkan, dan bukan oleh interaksi antarmolekul yang lemah, seperti dalam kasus zat molekuler. Untuk alasan yang sama, banyak kristal atom tidak meleleh ketika dipanaskan, tetapi terurai atau segera berubah menjadi uap (sublimasi), misalnya grafit menyublim pada 3700 o C.
Zat non-molekul dengan ikatan kovalen tidak larut dalam air dan pelarut lainnya; sebagian besar tidak menghantarkan arus listrik (kecuali grafit, yang bersifat konduktif, dan semikonduktor - silikon, germanium, dll.).
Ikatan kovalen adalah ikatan atom-atom yang menggunakan pasangan elektron yang sama (bersama di antara mereka). Dalam kata “kovalen”, awalan “co-” berarti “partisipasi bersama”. Dan "valens" yang diterjemahkan ke dalam bahasa Rusia berarti kekuatan, kemampuan. Dalam hal ini yang kami maksud adalah kemampuan atom untuk berikatan dengan atom lain.
Ketika ikatan kovalen terbentuk, atom menggabungkan elektronnya seolah-olah menjadi “celengan” yang sama - orbital molekul, yang terbentuk dari kulit atom masing-masing atom. Kulit baru ini mengandung elektron sebanyak mungkin dan menggantikan atom dengan kulit atomnya yang tidak lengkap.
Gagasan tentang mekanisme pembentukan molekul hidrogen diperluas ke molekul yang lebih kompleks. Teori ikatan kimia yang dikembangkan atas dasar ini disebut metode ikatan valensi (Metode VS). Metode BC didasarkan pada ketentuan sebagai berikut:
1) Ikatan kovalen dibentuk oleh dua elektron dengan spin berlawanan, dan pasangan elektron ini dimiliki oleh dua atom.
2) Semakin kuat ikatan kovalen, semakin banyak awan elektron yang tumpang tindih.
Kombinasi ikatan dua pusat dua elektron, yang mencerminkan struktur elektronik molekul, disebut skema valensi. Contoh pembuatan rangkaian valensi:
Skema valensi paling jelas mewujudkan representasi tersebut Lewis tentang pembentukan ikatan kimia melalui penggunaan bersama elektron dengan pembentukan kulit elektron gas mulia: untuk hidrogen– dari dua elektron (kulit Dia), Untuk nitrogen– dari delapan elektron (kulit Tidak).
29. Ikatan kovalen nonpolar dan polar.
Jika suatu molekul diatomik terdiri dari atom-atom dari satu unsur, maka awan elektron terdistribusi dalam ruang secara simetris relatif terhadap inti atom. Ikatan kovalen seperti ini disebut nonpolar.
Jika ikatan kovalen terbentuk antara atom-atom unsur yang berbeda, maka awan elektron bersama bergeser ke arah salah satu atom. Dalam hal ini, ikatan kovalen bersifat polar.
Akibat pembentukan ikatan kovalen polar, atom yang lebih elektronegatif memperoleh muatan parsial negatif, dan atom dengan keelektronegatifan lebih kecil memperoleh muatan parsial positif. Muatan ini biasanya disebut muatan efektif atom-atom dalam molekul. Mereka mungkin memiliki nilai pecahan.
30. Metode menyatakan ikatan kovalen. Ada dua cara utama pendidikan * .
ikatan kovalen 1) Pasangan elektron yang membentuk ikatan dapat terbentuk karena tidak berpasangan elektron , tersedia dalam tanpa kegembiraan atom . Peningkatan jumlah ikatan kovalen yang tercipta disertai dengan pelepasan lebih banyak energi daripada yang dikeluarkan untuk eksitasi atom. Karena valensi suatu atom bergantung pada jumlah elektron yang tidak berpasangan, eksitasi menyebabkan peningkatan valensi. Untuk atom nitrogen, oksigen, dan fluor, jumlah elektron tidak berpasangan tidak bertambah, karena tidak ada lowongan di tingkat kedua orbital*, dan pergerakan elektron ke tingkat kuantum ketiga membutuhkan energi yang jauh lebih besar daripada energi yang dilepaskan selama pembentukan ikatan tambahan. Dengan demikian, ketika atom tereksitasi, transisi elektron menjadi bebas.
orbital
Ikatan kovalen terjadi karena pembagian elektron milik kedua atom yang berpartisipasi dalam interaksi. Keelektronegatifan nonlogam cukup tinggi sehingga tidak terjadi transfer elektron.
Elektron dalam orbital elektron yang tumpang tindih digunakan bersama. Hal ini menciptakan situasi di mana tingkat elektron terluar atom terisi, yaitu terbentuk kulit terluar dengan 8 atau 2 elektron.
Keadaan di mana kulit elektron terisi penuh ditandai dengan energi terendah dan, karenanya, stabilitas maksimum.
Ada dua mekanisme pembentukan:
- donor-akseptor;
- menukarkan.
Dalam kasus pertama, salah satu atom menyediakan pasangan elektronnya, dan atom kedua menyediakan orbital elektron bebas.
Yang kedua, satu elektron dari setiap peserta interaksi menjadi pasangan yang sama.
Tergantung pada tipenya- atom atau molekul, senyawa dengan jenis ikatan serupa dapat sangat bervariasi dalam karakteristik fisikokimia.
Zat molekul paling sering berupa gas, cairan atau padatan dengan titik leleh dan titik didih rendah, tidak konduktif secara listrik, dan kekuatan rendah. Ini termasuk: hidrogen (H 2), oksigen (O 2), nitrogen (N 2), klorin (Cl 2), brom (Br 2), belerang belah ketupat (S 8), fosfor putih (P 4) dan zat sederhana lainnya ; karbon dioksida (CO 2), sulfur dioksida (SO 2), nitrogen oksida V (N 2 O 5), air (H 2 O), hidrogen klorida (HCl), hidrogen fluorida (HF), amonia (NH 3), metana (CH 4), etil alkohol (C 2 H 5 OH), polimer organik dan lain-lain.
Zat atom ada dalam bentuk kristal tahan lama dengan titik didih dan titik leleh tinggi, tidak larut dalam air dan pelarut lainnya, dan banyak yang tidak menghantarkan arus listrik. Contohnya adalah berlian yang memiliki kekuatan luar biasa. Hal ini dijelaskan oleh fakta bahwa intan merupakan kristal yang terdiri dari atom karbon yang dihubungkan melalui ikatan kovalen. Tidak ada molekul individu dalam berlian. Selain itu, zat seperti grafit, silikon (Si), silikon dioksida (SiO 2), silikon karbida (SiC) dan lain-lain memiliki struktur atom.
 Ikatan kovalen tidak hanya tunggal (seperti pada molekul klor Cl2), tetapi juga rangkap dua, seperti pada molekul oksigen O2, atau rangkap tiga, seperti misalnya pada molekul nitrogen N2. Pada saat yang sama, triple memiliki lebih banyak energi dan lebih tahan lama dibandingkan double dan tunggal.
Ikatan kovalen tidak hanya tunggal (seperti pada molekul klor Cl2), tetapi juga rangkap dua, seperti pada molekul oksigen O2, atau rangkap tiga, seperti misalnya pada molekul nitrogen N2. Pada saat yang sama, triple memiliki lebih banyak energi dan lebih tahan lama dibandingkan double dan tunggal.
Ikatan kovalen bisa saja terjadi terbentuk baik antara dua atom dari unsur yang sama (non-polar) maupun antara atom-atom dari unsur kimia yang berbeda (polar).
Tidak sulit untuk menunjukkan rumus senyawa dengan ikatan kovalen polar jika kita membandingkan nilai keelektronegatifan atom-atom penyusun molekulnya. Tidak ada perbedaan elektronegativitas yang akan menentukan non-polaritas. Jika terdapat perbedaan, maka molekulnya akan bersifat polar.
Jangan lewatkan: mekanisme pendidikan, contoh spesifik.
Ikatan kimia kovalen nonpolar
Ciri-ciri zat sederhana, bukan logam. Elektron dimiliki oleh atom secara merata, dan tidak ada pergeseran kerapatan elektron.
Contohnya termasuk molekul berikut:
H2, O2, O3, N2, F2, Cl2.
Pengecualian adalah gas inert. Tingkat energi luarnya terisi penuh, dan pembentukan molekul secara energetik tidak menguntungkan bagi mereka, dan oleh karena itu mereka ada dalam bentuk atom individu.
Selain itu, contoh zat dengan ikatan kovalen nonpolar adalah, misalnya, PH3. Meskipun suatu zat terdiri dari unsur-unsur yang berbeda, namun keelektronegatifan unsur-unsur tersebut sebenarnya tidak berbeda, yang berarti pasangan elektron tidak akan bergeser.
Ikatan kimia kovalen polar
Mengingat ikatan kovalen polar, banyak contoh yang dapat diberikan: HCl, H2O, H2S, NH3, CH4, CO2, SO3, CCl4, SiO2, CO.
terbentuk antara atom bukan logam dengan keelektronegatifan yang berbeda. Dalam hal ini, inti suatu unsur dengan keelektronegatifan lebih besar menarik elektron-elektron bersama lebih dekat ke dirinya sendiri.Skema pembentukan ikatan kovalen polar
Tergantung pada mekanisme pembentukannya, mereka bisa menjadi umum elektron dari satu atau kedua atom.
Gambar tersebut dengan jelas menunjukkan interaksi dalam molekul asam klorida.
Sepasang elektron milik satu atom dan atom kedua, keduanya, sehingga tingkat terluarnya terisi. Namun klor yang lebih elektronegatif menarik sepasang elektron yang sedikit lebih dekat ke dirinya (sementara elektron tersebut tetap digunakan bersama). Perbedaan keelektronegatifan tidak cukup besar sehingga sepasang elektron dapat berpindah sepenuhnya ke salah satu atom. Akibatnya, muncul muatan parsial negatif pada klorin dan muatan parsial positif pada hidrogen. Molekul HCl adalah molekul polar.
Sifat fisika-kimia ikatan
Koneksi dapat dicirikan oleh sifat-sifat berikut: directivity, polaritas, polarisasi dan saturasi.

Kovalen, ionik, dan logam adalah tiga jenis ikatan kimia utama.
Mari kita mengenal lebih jauh tentangnya ikatan kimia kovalen. Mari kita perhatikan mekanisme kemunculannya. Mari kita ambil contoh pembentukan molekul hidrogen:
Awan simetris berbentuk bola yang dibentuk oleh elektron 1s mengelilingi inti atom hidrogen bebas. Ketika atom mendekati jarak tertentu, sebagian orbitalnya tumpang tindih (lihat gambar),  akibatnya, awan molekul dua elektron muncul di antara pusat kedua inti, yang memiliki kerapatan elektron maksimum di ruang antar inti. Dengan peningkatan kepadatan muatan negatif, terjadi peningkatan kuat gaya tarik-menarik antara awan molekul dan inti.
akibatnya, awan molekul dua elektron muncul di antara pusat kedua inti, yang memiliki kerapatan elektron maksimum di ruang antar inti. Dengan peningkatan kepadatan muatan negatif, terjadi peningkatan kuat gaya tarik-menarik antara awan molekul dan inti.
Jadi, kita melihat bahwa ikatan kovalen terbentuk karena tumpang tindih awan elektron atom, yang disertai dengan pelepasan energi. Jika jarak inti atom yang mendekat sebelum bersentuhan adalah 0,106 nm, maka setelah awan elektron tumpang tindih menjadi 0,074 nm. Semakin besar tumpang tindih orbital elektron, semakin kuat ikatan kimianya.
Kovalen ditelepon ikatan kimia yang dilakukan oleh pasangan elektron. Senyawa yang mempunyai ikatan kovalen disebut homeopolar atau atom.
Ada dua jenis ikatan kovalen: kutub Dan non-polar.
Untuk non-polar Dalam ikatan kovalen, awan elektron yang dibentuk oleh sepasang elektron yang sama terdistribusi secara simetris terhadap inti kedua atom. Contohnya adalah molekul diatomik yang terdiri dari satu unsur: Cl 2, N 2, H 2, F 2, O 2 dan lain-lain, pasangan elektron yang dimiliki kedua atom sama.
Di kutub Dalam ikatan kovalen, awan elektron bergeser ke arah atom dengan keelektronegatifan relatif lebih tinggi. Misalnya molekul senyawa anorganik yang mudah menguap seperti H 2 S, HCl, H 2 O dan lain-lain.
Pembentukan molekul HCl dapat direpresentasikan sebagai berikut:
![]()
Karena elektronegativitas relatif atom klor (2,83) lebih besar dibandingkan atom hidrogen (2.1), pasangan elektron bergeser ke atom klor.
Selain mekanisme pertukaran, pembentukan ikatan kovalen juga terjadi karena tumpang tindih donor-akseptor mekanisme pembentukannya. Ini adalah mekanisme di mana pembentukan ikatan kovalen terjadi karena adanya awan dua elektron dari satu atom (donor) dan orbital bebas atom lain (akseptor). Mari kita lihat contoh mekanisme pembentukan amonium NH 4+. Dalam molekul amonia, atom nitrogen memiliki awan dua elektron:
Ion hidrogen mempunyai orbital 1s bebas, kita nyatakan sebagai .
Selama pembentukan ion amonium, awan nitrogen dua elektron menjadi sama dengan atom nitrogen dan hidrogen, yang berarti diubah menjadi awan elektron molekul. Akibatnya, ikatan kovalen keempat muncul. Anda dapat membayangkan proses pembentukan amonium dengan diagram berikut: 
Muatan ion hidrogen tersebar di antara semua atom, dan awan dua elektron milik nitrogen berbagi dengan hidrogen.
Masih ada pertanyaan? Tidak tahu bagaimana mengerjakan pekerjaan rumah Anda?
Untuk mendapatkan bantuan dari tutor, daftarlah.
Pelajaran pertama gratis!
situs web, ketika menyalin materi secara keseluruhan atau sebagian, diperlukan tautan ke sumbernya.
Ikatan kimia kovalen terjadi antara atom-atom yang nilai keelektronegatifannya sama atau sama. Misalkan klor dan hidrogen cenderung mengambil elektron dan mengambil struktur gas mulia terdekat, yang berarti keduanya tidak akan memberikan elektron kepada yang lain. Bagaimana mereka masih terhubung? Sederhana saja - mereka berbagi satu sama lain, pasangan elektron yang sama terbentuk.

Sekarang mari kita lihat ciri-ciri khas ikatan kovalen.
Berbeda dengan senyawa ionik, molekul senyawa kovalen terikat satu sama lain melalui “gaya antarmolekul”, yang jauh lebih lemah dibandingkan ikatan kimia. Dalam hal ini, ikatan kovalen merupakan ciri khasnya saturasi– pembentukan sejumlah koneksi terbatas.
Diketahui bahwa orbital atom mempunyai orientasi dalam ruang dengan cara tertentu, oleh karena itu, ketika suatu ikatan terbentuk, terjadi tumpang tindih awan elektron pada arah tertentu. Itu. properti ikatan kovalen direalisasikan sebagai arah.
Jika ikatan kovalen dalam suatu molekul dibentuk oleh atom-atom identik atau atom-atom yang keelektronegatifannya sama, maka ikatan tersebut tidak mempunyai polaritas, yaitu kerapatan elektron terdistribusi secara simetris. Itu disebut ikatan kovalen non-polar ( H2, Cl2, O2 ). Obligasi bisa tunggal, ganda, atau rangkap tiga.
Jika keelektronegatifan atom-atom berbeda, maka ketika mereka bergabung, kerapatan elektron terdistribusi secara tidak merata di antara atom-atom dan terbentuklah ikatan kovalen polar(HCl, H 2 O, CO), yang multiplisitasnya juga bisa berbeda. Ketika jenis ikatan ini terbentuk, atom yang lebih elektronegatif memperoleh muatan parsial negatif, dan atom dengan elektronegativitas lebih kecil memperoleh muatan parsial positif (δ- dan δ+). Dipol listrik terbentuk di mana muatan-muatan yang berlawanan tanda terletak pada jarak tertentu satu sama lain. Momen dipol digunakan sebagai ukuran polaritas ikatan:

Semakin jelas polaritas sambungan, semakin besar momen dipolnya. Molekul akan menjadi non-polar jika momen dipolnya nol.
Sehubungan dengan ciri-ciri di atas, dapat kita simpulkan bahwa senyawa kovalen bersifat mudah menguap dan mempunyai titik leleh dan titik didih yang rendah. Arus listrik tidak dapat melewati sambungan ini, oleh karena itu sambungan ini merupakan konduktor yang buruk dan isolator yang baik. Ketika panas diterapkan, banyak senyawa dengan ikatan kovalen terbakar. Sebagian besar adalah hidrokarbon, serta oksida, sulfida, halida non-logam, dan logam transisi.
Kategori,