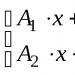Tentunya setiap orang pernah menghadapi situasi di mana, karena kurangnya informasi, salah tafsir terhadap emosi dan perasaan orang lain, seseorang salah menilai tindakan orang lain. Seringkali, kesimpulan ini didasarkan pada dugaan sendiri atau opini yang ada tentang seseorang.
Sejarah dan penelitian fenomena dalam psikologi
Pendiri istilah “atribusi kausal” dalam psikologi adalah peneliti F. Heider pada pertengahan abad kedua puluh. Dia adalah orang pertama yang menyuarakan diagram yang menunjukkan alasan mengapa seseorang menciptakan opini tentang suatu peristiwa atau orang. Ide Heider segera diambil alih oleh psikolog lain, terutama Lee Ross dan George Kelly.
Kelly melakukan banyak pekerjaan dalam memahami penyebab perilaku, memperluas jangkauan penelitian ke dasar atribusi. Semakin seseorang mengenal orang lain, semakin besar keinginannya untuk mengetahui motif tindakannya . Dalam proses kognisi, seseorang mengandalkan data yang sudah diketahuinya, namun terkadang data tersebut terlalu sedikit untuk menciptakan gambaran holistik tentang perilaku dan menjelaskan tindakan. Pertanyaannya tidak bisa tetap tidak terselesaikan; karena kurangnya informasi, seseorang mulai memikirkan tentang apa yang tidak dapat dia jelaskan. Artinya, ketidaktahuan akan alasan tindakan orang lain memberi seseorang alasan untuk menciptakannya sendiri, berdasarkan pengamatannya sendiri terhadap perilaku orang lain. digambarkan dalam psikologi sebagai "atribusi kausal".
Kriteria untuk menghubungkan penyebab perilaku dengan Kelly.
Atribusi kausal sebagai sebuah fenomena membantu membuat langkah signifikan dalam teorinya, Kelly mencoba menetapkan kriteria apa yang digunakan seseorang ketika mencoba menjelaskan alasan perilaku orang lain. Selama penelitian, 3 kriteria ditetapkan:
perilaku ini konstan bagi seseorang (kriteria keteguhan);
perilaku seperti itu membedakan seseorang dari orang lain (kriteria eksklusivitas);
normalitas perilaku (kriteria konsensus).

Jika seseorang memecahkan suatu masalah dengan cara yang sama seperti masalah sebelumnya, maka perilakunya bersifat permanen. Ketika, ketika menjawab pertanyaan yang jelas, seseorang menjawab dengan cara yang sangat berbeda, kesimpulan tentang prinsip eksklusivitas muncul dengan sendirinya. “Dalam situasi saat ini, banyak orang berperilaku seperti ini” adalah bukti langsung adanya kesamaan. Dalam mencari alasan untuk menjelaskan perilaku orang lain, seseorang kurang lebih cocok dengan skema ini. Ini hanya memberikan karakteristik umum, dan serangkaian alasannya bersifat individual untuk setiap orang. Pertanyaannya tetap, atribusi kausal manakah yang belum dapat dijawab: dalam situasi apa seseorang akan menggunakan masing-masing kriteria?
Manifestasi atribusi kausal dalam hubungannya dengan diri sendiri dan orang lain

Keunikan dari fenomena ini adalah seseorang menerapkan motif perilaku yang sangat berbeda terhadap dirinya sendiri. Kesalahan atribusi kausal adalah seseorang membenarkan tindakan orang lain dengan kualitas pribadinya. Dan dia menjelaskan tindakannya berdasarkan keadaan eksternal - tentu saja, karena kita lebih toleran terhadap diri kita sendiri. Dalam keadaan orang lain belum menyelesaikan tugas yang diberikan kepadanya, kita memberinya predikat orang yang malas dan tidak bertanggung jawab. Jika saya tidak menyelesaikan tugas, berarti cuaca, musik keras di luar tembok, dll mengganggu saya. Alasan dari gagasan ini adalah karena kita menganggap perilaku kita normal, dan kita menafsirkan perilaku yang berbeda dari perilaku kita sebagai tidak normal.
Oksida.
Ini adalah zat kompleks yang terdiri dari DUA unsur, salah satunya adalah oksigen. Misalnya:
CuO – tembaga(II) oksida
AI 2 O 3 – aluminium oksida
JADI 3 – oksida belerang (VI)
Oksida dibagi (diklasifikasikan) menjadi 4 kelompok:
Na 2 O– Natrium oksida
CaO – Kalsium Oksida
Fe 2 O 3 – besi (III) oksida
2). Asam– Ini adalah oksida non-logam. Dan terkadang logam jika bilangan oksidasi logam > 4. Contoh:
CO 2 – Karbon monoksida (IV)
P 2 O 5 – Fosfor (V) oksida
JADI 3 – Sulfur oksida (VI)
3). Amfoter– Ini adalah oksida yang memiliki sifat oksida basa dan asam. Anda perlu mengetahui lima oksida amfoter yang paling umum:
BeO–berilium oksida
ZnO–seng oksida
AI 2 O 3 – Aluminium oksida
Cr 2 O 3 – Kromium (III) oksida
Fe 2 O 3 – Besi (III) oksida
4). Tidak membentuk garam (acuh tak acuh)– Ini adalah oksida yang tidak menunjukkan sifat oksida basa atau asam. Ada tiga oksida yang perlu diingat:
CO – karbon monoksida (II) karbon monoksida
TIDAK – oksida nitrat (II)
N 2 O – oksida nitrat (I) gas tertawa, dinitrogen oksida
Metode untuk memproduksi oksida.
1). Pembakaran, mis. interaksi dengan oksigen dari zat sederhana:
4Na + O 2 = 2Na 2 O
4P + 5O 2 = 2P 2 O 5
2). Pembakaran, mis. interaksi dengan oksigen dari zat kompleks (terdiri dari dua elemen) sehingga terbentuk dua oksida.
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
3). Penguraian tiga asam lemah. Yang lainnya tidak terurai. Dalam hal ini, oksida asam dan air terbentuk.
H 2 CO 3 = H 2 O + CO 2
H 2 JADI 3 = H 2 O + JADI 2
H 2 SiO 3 = H 2 O + SiO 2
4). Penguraian tidak larut alasan. Oksida basa dan air terbentuk.
Mg(OH)2 = MgO + H2O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
5). Penguraian tidak larut garam Oksida basa dan oksida asam terbentuk.
CaCO3 = CaO + CO2
MgSO3 = MgO + SO2
Sifat kimia.
SAYA. Oksida basa.
alkali.
Na 2 O + H 2 O = 2NaOH
CaO + H 2 O = Ca(OH) 2
СuO + H 2 O = reaksi tidak terjadi, karena kemungkinan basa yang mengandung tembaga - tidak larut
2). Interaksi dengan asam, mengakibatkan terbentuknya garam dan air. (Basa oksida dan asam SELALU bereaksi)
K2O + 2HCI = 2KCl + H2O
CaO + 2HNO 3 = Ca(NO 3) 2 + H 2 O
3). Interaksi dengan oksida asam, menghasilkan pembentukan garam.
Li 2 O + CO 2 = Li 2 CO 3
3MgO + P 2 O 5 = Mg 3 (PO 4) 2
4). Interaksi dengan hidrogen menghasilkan logam dan air.
CuO + H 2 = Cu + H 2 O
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
II.Oksida asam.
1). Interaksi dengan air harus terbentuk asam.(HanyaSiO 2 tidak berinteraksi dengan air)
CO 2 + H 2 O = H 2 CO 3
P 2 O 5 + 3H 2 O = 2H 3 PO 4
2). Interaksi dengan basa larut (alkali). Ini menghasilkan garam dan air.
JADI 3 + 2KOH = K 2 JADI 4 + H 2 O
N 2 O 5 + 2KOH = 2KNO 3 + H 2 O
3). Interaksi dengan oksida basa. Dalam hal ini, hanya garam yang terbentuk.
N 2 O 5 + K 2 O = 2KNO 3
Al 2 O 3 + 3SO 3 = Al 2 (SO 4) 3
Latihan dasar.
1). Lengkapi persamaan reaksinya. Tentukan jenisnya.
K 2 O + P 2 O 5 =
Larutan.
Untuk menuliskan apa yang terbentuk sebagai hasilnya, perlu ditentukan zat apa yang bereaksi - ini kalium oksida (basa) dan fosfor oksida (asam) menurut sifat - hasilnya harus GARAM (lihat sifat No. 3 ) dan garam terdiri dari atom logam (dalam kasus kita kalium) dan residu asam yang meliputi fosfor (yaitu PO 4 -3 - fosfat) Oleh karena itu
3K 2 O + P 2 O 5 = 2K 3 RO 4
jenis reaksi - senyawa (karena dua zat bereaksi, tetapi satu zat terbentuk)
2). Melakukan transformasi (rantai).
Ca → CaO → Ca(OH) 2 → CaCO 3 → CaO
Larutan
Untuk menyelesaikan latihan ini, Anda harus ingat bahwa setiap panah merupakan satu persamaan (satu reaksi kimia). Mari beri nomor pada setiap panah. Oleh karena itu, perlu dituliskan 4 persamaan. Zat yang ditulis di sebelah kiri panah (zat awal) bereaksi, dan zat yang ditulis di sebelah kanan terbentuk sebagai hasil reaksi (hasil reaksi). Mari kita menguraikan bagian pertama dari rekaman:
Ca + …..→ CaO Kita perhatikan bahwa zat sederhana bereaksi dan oksida terbentuk. Mengetahui metode produksi oksida (No. 1), kami sampai pada kesimpulan bahwa dalam reaksi ini perlu ditambahkan -oksigen (O 2)
2Ca + O 2 → 2CaO
Mari kita beralih ke transformasi No.2
CaO → Ca(OH) 2
CaO + ……→ Ca(OH) 2
Kami sampai pada kesimpulan bahwa di sini perlu menerapkan sifat oksida basa - interaksi dengan air, karena hanya dalam hal ini basa terbentuk dari oksida.
CaO + H 2 O → Ca(OH) 2
Mari kita beralih ke transformasi No.3
Ca(OH)2 → CaCO3
Ca(OH) 2 + ….. = CaCO 3 + …….
Kami sampai pada kesimpulan bahwa di sini kita berbicara tentang karbon dioksida CO 2 karena hanya ketika berinteraksi dengan basa ia membentuk garam (lihat sifat No. 2 oksida asam)
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
Mari kita beralih ke transformasi No.4
CaCO 3 → CaO
CaCO 3 = ….. CaO + ……
Kami sampai pada kesimpulan bahwa lebih banyak CO 2 yang terbentuk di sini, karena CaCO 3 adalah garam yang tidak larut dan selama penguraian zat-zat inilah oksida terbentuk.
CaCO3 = CaO + CO2
3). Manakah dari zat berikut yang berinteraksi dengan CO 2? Tuliskan persamaan reaksinya.
A). Asam klorida B). Natrium hidroksida B). Kalium oksida d). Air
D). Hidrogen E). Belerang(IV) oksida.
Kami menentukan bahwa CO 2 adalah oksida asam. Dan oksida asam bereaksi dengan air, basa, dan oksida basa... Oleh karena itu, dari daftar yang diberikan kami memilih jawaban B, C, D Dan bersama mereka kami menuliskan persamaan reaksi:
1). CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
2). BERSAMA 2 + K 2 O = K 2 BERSAMA 3
Jika Anda tidak tertarik pada kimia di sekolah, kemungkinan besar Anda tidak akan langsung mengingat apa itu oksida dan apa perannya dalam lingkungan. Ini sebenarnya adalah jenis senyawa yang cukup umum dan paling sering ditemukan di lingkungan dalam bentuk air, karat, karbon dioksida, dan pasir. Oksida juga termasuk mineral - sejenis batuan yang memiliki struktur kristal.
Definisi
Oksida adalah senyawa kimia yang rumusnya mengandung paling sedikit satu atom oksigen dan atom unsur kimia lainnya. Oksida logam biasanya mengandung anion oksigen dalam keadaan oksidasi -2. Sebagian besar kerak bumi terdiri dari oksida padat yang muncul selama oksidasi unsur-unsur dengan oksigen dari udara atau air. Ketika hidrokarbon dibakar, dua oksida karbon utama dihasilkan: karbon monoksida (karbon monoksida, CO) dan karbon dioksida (karbon dioksida, CO2).
Klasifikasi oksida
Semua oksida biasanya dibagi menjadi dua kelompok besar:
- oksida pembentuk garam;
- oksida yang tidak membentuk garam.
Oksida pembentuk garam adalah zat kimia yang selain oksigen, mengandung unsur logam dan nonlogam, yang jika bersentuhan dengan air membentuk asam, dan bila digabungkan dengan basa, garam.
Oksida pembentuk garam pada gilirannya dibagi menjadi:
- oksida basa yang, setelah oksidasi, unsur kedua (logam bervalensi 1, 2 dan kadang-kadang 3) menjadi kation (Li 2 O, Na 2 O, K 2 O, CuO, Ag 2 O, MgO, CaO, SrO, BaO, HgO , MnO, CrO, NiO, Fr 2 O, Cs 2 O, Rb 2 O, FeO);
- oksida asam di mana, selama pembentukan garam, unsur kedua terikat pada atom oksigen bermuatan negatif (CO 2, SO 2, SO 3, SiO 2, P 2 O 5, CrO 3, Mn 2 O 7, NO 2, Cl 2 O 5, Cl 2 O 3);
- oksida amfoter dimana unsur kedua (logam bervalensi 3 dan 4 atau pengecualian seperti seng oksida, berilium oksida, timah oksida dan timbal oksida) dapat menjadi kation atau bergabung dengan anion (ZnO, Cr 2 O 3, Al 2 O 3 , SnO, SnO 2, PbO, PbO 2, TiO 2, MnO 2, Fe 2 O 3, BeO).
Oksida yang tidak membentuk garam tidak menunjukkan sifat asam, basa, atau amfoter dan, sesuai dengan namanya, tidak membentuk garam (CO, NO, NO 2, (FeFe 2)O 4).
Sifat oksida
- Atom oksigen dalam oksida memiliki aktivitas kimia yang tinggi. Karena kenyataan bahwa atom oksigen selalu bermuatan negatif, ia membentuk ikatan kimia yang stabil dengan hampir semua unsur, yang menghasilkan berbagai macam oksida.
- Logam mulia seperti emas dan platinum dihargai karena tidak teroksidasi secara alami. Korosi logam terjadi akibat hidrolisis atau oksidasi dengan oksigen. Kombinasi air dan oksigen hanya mempercepat laju reaksi.
- Dengan adanya air dan oksigen (atau hanya udara), reaksi oksidasi beberapa unsur, misalnya natrium, terjadi dengan cepat dan dapat berbahaya bagi manusia.
- Oksida membuat lapisan oksida pelindung di permukaan. Contohnya adalah aluminium foil, yang karena lapisannya berupa lapisan tipis aluminium oksida, terkorosi jauh lebih lambat.
- Oksida dari sebagian besar logam memiliki struktur polimer, sehingga tidak dihancurkan oleh pelarut.
- Oksida larut di bawah pengaruh asam dan basa. Oksida yang dapat bereaksi dengan asam dan basa disebut amfoter. Logam biasanya membentuk oksida basa, nonlogam membentuk oksida asam, dan oksida amfoter berasal dari logam alkali (metaloid).
- Jumlah oksida logam dapat dikurangi dengan aksi senyawa organik tertentu. Reaksi redoks ini mendasari banyak transformasi kimia penting, seperti detoksifikasi obat oleh enzim P450 dan produksi etilen oksida, yang kemudian digunakan untuk membuat antibeku.
Mereka yang tertarik dengan kimia juga akan tertarik dengan artikel berikut ini.
Oksida adalah senyawa anorganik yang terdiri dari dua unsur kimia, salah satunya adalah oksigen dengan bilangan oksidasi -2. Satu satunya unsur yang tidak membentuk oksida adalah fluor, yang bergabung dengan oksigen untuk membentuk oksigen fluorida. Hal ini disebabkan oleh fakta bahwa fluor adalah unsur yang lebih elektronegatif daripada oksigen.
Golongan senyawa ini sangat umum. Setiap hari seseorang menjumpai berbagai macam oksida dalam kehidupan sehari-hari. Air, pasir, karbon dioksida yang kita hembuskan, knalpot mobil, karat adalah contoh oksida.
Klasifikasi oksida
Semua oksida, menurut kemampuannya membentuk garam, dapat dibagi menjadi dua kelompok:
- Pembentuk garam oksida (CO 2, N 2 O 5, Na 2 O, SO 3, dll.)
- Tidak membentuk garam oksida (CO, N 2 O, SiO, NO, dll.)
Pada gilirannya, oksida pembentuk garam dibagi menjadi 3 kelompok:
- Oksida basa- (Oksida logam - Na 2 O, CaO, CuO, dll.)
- Oksida asam- (Oksida nonlogam, serta oksida logam pada bilangan oksidasi V-VII - Mn 2 O 7, CO 2, N 2 O 5, SO 2, SO 3, dst.)
- (Oksida logam dengan bilangan oksidasi III-IV serta ZnO, BeO, SnO, PbO)
Klasifikasi ini didasarkan pada manifestasi sifat kimia tertentu oleh oksida. Jadi, oksida basa berhubungan dengan basa, dan oksida asam berhubungan dengan asam. Oksida asam bereaksi dengan oksida basa membentuk garam yang sesuai, seolah-olah basa dan asam yang berhubungan dengan oksida ini bereaksi:  Juga, Basa amfoter berhubungan dengan oksida amfoter, yang dapat menunjukkan sifat asam dan basa:
Juga, Basa amfoter berhubungan dengan oksida amfoter, yang dapat menunjukkan sifat asam dan basa:  Unsur kimia yang menunjukkan bilangan oksidasi berbeda dapat membentuk berbagai oksida. Untuk membedakan oksida dari unsur-unsur tersebut, setelah nama oksida, valensi ditunjukkan dalam tanda kurung.
Unsur kimia yang menunjukkan bilangan oksidasi berbeda dapat membentuk berbagai oksida. Untuk membedakan oksida dari unsur-unsur tersebut, setelah nama oksida, valensi ditunjukkan dalam tanda kurung.
CO 2 – karbon monoksida (IV)
N 2 O 3 – oksida nitrat (III)
Sifat fisik oksida
Oksida sangat beragam dalam sifat fisiknya. Mereka dapat berupa cairan (H 2 O), gas (CO 2, SO 3) atau padatan (Al 2 O 3, Fe 2 O 3). Selain itu, oksida basa biasanya berbentuk padat. Oksida juga memiliki beragam warna - dari tidak berwarna (H 2 O, CO) dan putih (ZnO, TiO 2) hingga hijau (Cr 2 O 3) dan bahkan hitam (CuO).
Oksida basa
Beberapa oksida bereaksi dengan air membentuk hidroksida (basa): Oksida basa bereaksi dengan oksida asam membentuk garam: Mereka bereaksi serupa dengan asam, tetapi dengan pelepasan air: Oksida dari logam yang kurang aktif dibandingkan aluminium dapat direduksi menjadi logam:
Oksida asam
Oksida asam bereaksi dengan air membentuk asam: Beberapa oksida (misalnya silikon oksida SiO2) tidak bereaksi dengan air, sehingga asam diperoleh dengan cara lain.
Oksida asam berinteraksi dengan oksida basa, membentuk garam: Dengan cara yang sama, dengan pembentukan garam, oksida asam bereaksi dengan basa: Jika asam polibasa berhubungan dengan oksida tertentu, maka garam asam juga dapat terbentuk: Oksida asam yang tidak mudah menguap dapat menggantikan oksida volatil dalam garam:
Seperti disebutkan sebelumnya, oksida amfoter, tergantung pada kondisinya, dapat menunjukkan sifat asam dan basa. Jadi mereka bertindak sebagai oksida basa dalam reaksi dengan asam atau oksida asam, membentuk garam: Dan dalam reaksi dengan basa atau oksida basa mereka menunjukkan sifat asam: 
Memperoleh oksida
Oksida dapat diperoleh dengan berbagai cara; kami akan menyajikan yang utama.
Kebanyakan oksida dapat diperoleh melalui interaksi langsung oksigen dengan unsur kimia:  Saat memanggang atau membakar berbagai senyawa biner: Dekomposisi termal garam, asam dan basa:
Saat memanggang atau membakar berbagai senyawa biner: Dekomposisi termal garam, asam dan basa:  Interaksi beberapa logam dengan air:
Interaksi beberapa logam dengan air:
Penerapan oksida
 Oksida sangat umum di seluruh dunia dan digunakan baik dalam kehidupan sehari-hari maupun dalam industri. Oksida yang paling penting, hidrogen oksida, air, memungkinkan adanya kehidupan di Bumi. Sulfur oksida SO 3 digunakan untuk memproduksi asam sulfat, serta untuk memproses produk makanan - hal ini meningkatkan umur simpan, misalnya buah-buahan.
Oksida sangat umum di seluruh dunia dan digunakan baik dalam kehidupan sehari-hari maupun dalam industri. Oksida yang paling penting, hidrogen oksida, air, memungkinkan adanya kehidupan di Bumi. Sulfur oksida SO 3 digunakan untuk memproduksi asam sulfat, serta untuk memproses produk makanan - hal ini meningkatkan umur simpan, misalnya buah-buahan.
Oksida besi digunakan untuk memperoleh cat dan menghasilkan elektroda, meskipun sebagian besar oksida besi direduksi menjadi besi metalik dalam metalurgi.
Kalsium oksida, juga dikenal sebagai kapur tohor, digunakan dalam konstruksi. Seng dan titanium oksida berwarna putih dan tidak larut dalam air, itulah sebabnya mereka menjadi bahan yang baik untuk produksi cat - putih.
Silikon oksida SiO 2 adalah komponen utama kaca. Kromium oksida Cr 2 O 3 digunakan untuk produksi kaca dan keramik berwarna hijau, dan karena sifat kekuatannya yang tinggi, untuk produk pemoles (dalam bentuk pasta Pemerintah Indonesia).
Karbon monoksida CO 2, yang dikeluarkan oleh semua organisme hidup saat bernafas, digunakan untuk memadamkan api, dan juga, dalam bentuk es kering, untuk mendinginkan sesuatu.
Oksida adalah zat yang molekulnya terdiri dari atom oksigen dengan bilangan oksidasi - 2 dan atom dari beberapa unsur kedua.
Oksida terbentuk secara langsung melalui interaksi oksigen dengan zat lain atau secara tidak langsung melalui penguraian basa, garam, dan asam. Senyawa jenis ini sangat umum ditemukan di alam, dan dapat berbentuk gas, cair, atau oksida. Kerak bumi juga mengandung oksida. Jadi, pasir, karat, dan bahkan air biasa - itu saja
Ada oksida pembentuk garam dan oksida non pembentuk garam. Pembentuk garam menghasilkan garam sebagai hasil reaksi kimia. Ini termasuk oksida non-logam dan logam, yang bereaksi dengan air membentuk asam, dan ketika bereaksi dengan basa, garam, normal dan asam. Agen pembentuk garam termasuk, misalnya,
Oleh karena itu, tidak mungkin memperoleh garam dari zat yang bukan pembentuk garam. Contohnya termasuk dinitrogen oksida dan
Oksida pembentuk garam dibagi lagi menjadi basa, asam, dan amfoter. Mari kita bicara lebih banyak tentang yang utama.
Jadi, oksida basa adalah oksida dari beberapa logam, hidroksida yang bersangkutan termasuk dalam kelas basa. Artinya, ketika berinteraksi dengan asam, zat tersebut membentuk air dan garam. Misalnya, K2O, CaO, MgO, dll. Dalam kondisi normal, oksida basa adalah formasi kristal padat. Bilangan oksidasi logam dalam senyawa tersebut, biasanya, tidak melebihi +2 atau jarang +3.
Sifat kimia oksida basa
1. Reaksi dengan asam
Dalam reaksi dengan asam oksida menunjukkan sifat basanya, sehingga percobaan serupa dapat membuktikan jenis oksida tertentu. Jika garam dan air terbentuk, maka itu adalah oksida basa. Oksida asam dalam reaksi seperti itu membentuk asam. Dan yang amfoter dapat menunjukkan sifat asam atau basa - tergantung kondisi. Inilah perbedaan utama antara oksida yang tidak membentuk garam.
2. Reaksi dengan air
Oksida-oksida yang dibentuk oleh logam dari rentang tegangan listrik di depan magnesium berinteraksi dengan air. Ketika bereaksi dengan air, mereka membentuk basa yang larut. Ini adalah sekelompok oksida alkali tanah (barium oksida, litium oksida, dll.). Oksida asam membentuk asam dalam air, sedangkan oksida amfoter tidak bereaksi terhadap air.
3. Reaksi dengan oksida amfoter dan asam
Zat-zat yang berlawanan secara kimia bereaksi satu sama lain, membentuk garam. Misalnya, oksida basa dapat berinteraksi dengan oksida asam, tetapi tidak bereaksi dengan anggota lain dari kelompoknya. Yang paling aktif adalah oksida logam alkali, alkali tanah dan magnesium. Bahkan dalam kondisi normal, mereka menyatu dengan oksida amfoter padat dan oksida asam padat dan gas. Ketika bereaksi dengan oksida asam, mereka membentuk garam yang sesuai.
Tetapi oksida basa dari logam lain kurang aktif dan praktis tidak bereaksi dengan oksida gas (asam). Mereka hanya dapat mengalami reaksi adisi ketika menyatu dengan oksida asam padat.
4. Sifat redoks
Oksida logam alkali aktif tidak menunjukkan sifat pereduksi atau pengoksidasi yang nyata. Sebaliknya, oksida logam yang kurang aktif dapat direduksi dengan batu bara, hidrogen, amonia, atau karbon monoksida.
Persiapan oksida basa
1. Penguraian hidroksida: Ketika dipanaskan, basa yang tidak larut terurai menjadi air dan oksida basa.
2. Oksidasi logam: logam alkali, bila dibakar dalam oksigen, membentuk peroksida, yang kemudian, jika direduksi, membentuk oksida basa.