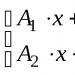Pelajaran kimia di kelas 8. "____"______________ 20___
Pembubaran. Kelarutan zat dalam air.
Target. Memperluas dan memperdalam pemahaman siswa tentang proses penyelesaian dan disolusi.
Tujuan pendidikan: menentukan apa yang dimaksud dengan larutan, menganggap proses pelarutan sebagai proses fisika dan kimia; memperluas pemahaman Anda tentang struktur zat dan proses kimia yang terjadi dalam larutan; pertimbangkan jenis solusi utama.
Tujuan pengembangan: Terus mengembangkan keterampilan berbicara, keterampilan observasi dan kemampuan menarik kesimpulan berdasarkan pekerjaan laboratorium.
Tujuan pendidikan: untuk menumbuhkan pandangan dunia siswa melalui studi tentang proses kelarutan, karena kelarutan suatu zat merupakan karakteristik penting untuk pembuatan larutan dalam kehidupan sehari-hari, kedokteran dan sektor penting lainnya dalam industri dan kehidupan manusia.
Kemajuan pelajaran.
Apa solusinya? Bagaimana cara menyiapkan solusinya?
Pengalaman No.1. Tempatkan kristal kalium permanganat dalam segelas air. Apa yang kita lihat? Fenomena apa yang dimaksud dengan proses disolusi?
Percobaan No. 2. Tuang 5 ml air ke dalam tabung reaksi. Kemudian tambahkan 15 tetes asam sulfat pekat (H2SO4 konsentrasi). Apa yang kita lihat? (Jawaban: tabung reaksi memanas, terjadi reaksi eksotermik yang berarti pelarutan merupakan proses kimia).
Pengalaman No.3. Tambahkan 5 ml air ke dalam tabung reaksi dengan natrium nitrat. Apa yang kita lihat? (Jawab: tabung reaksi menjadi lebih dingin, terjadi reaksi endoterm yang berarti pelarutan merupakan proses kimia).
Proses pelarutan dianggap sebagai proses fisikokimia.
Halaman 211 isi tabelnya.
| Tanda-tanda perbandingan | Teori fisika | Teori kimia. |
| Pendukung teori tersebut | Van't Hoff, Arrhenius, Ostwald | Mendeleev. |
| Penentuan pembubaran | Proses pembubaran merupakan hasil difusi, yaitu. penetrasi zat terlarut ke dalam ruang antar molekul air | Interaksi kimia suatu zat terlarut dengan molekul air |
| Definisi solusi | Campuran homogen yang terdiri dari dua atau lebih bagian homogen. | Sistem homogen yang terdiri dari partikel zat terlarut, pelarut, dan produk interaksinya. |
Kelarutan padatan dalam air bergantung pada:
Tugas: mengamati pengaruh suhu terhadap kelarutan zat.
Perintah eksekusi:
Tuang air (1/3 volume) ke dalam tabung reaksi No. 1 dan No. 2 yang berisi nikel sulfat.
Panaskan tabung reaksi No. 1, perhatikan tindakan pencegahan keselamatan.
Di antara tabung reaksi No. 1 atau No. 2 yang diusulkan, proses pembubarannya berlangsung lebih cepat?
Buatlah kesimpulan tentang pengaruh suhu terhadap kelarutan zat.
Gambar 126 halaman 213
A) kelarutan kalium klorida pada 30 0C adalah 40 gram
pada 65 0 DENGAN adalah 50 gram.
B) kelarutan kalium sulfat pada 40 0C adalah 10 g
pada 800C adalah 20
B) kelarutan barium klorida pada 90 0C adalah 60 gram
pada 0 0 DENGAN adalah 30 gram.
Tugas: mengamati pengaruh sifat zat terlarut terhadap proses pelarutan.
Perintah eksekusi:
Tambahkan 5 ml air ke dalam 3 tabung reaksi yang berisi zat: kalsium klorida, kalsium hidroksida, kalsium karbonat, tutup dan kocok rata agar zat lebih larut.
Manakah dari zat yang diusulkan yang larut dengan baik dalam air? Yang mana yang tidak larut?
Jadi, proses pelarutan bergantung pada sifat zat terlarut:
Sangat larut: (masing-masing tiga contoh)
Sedikit larut:
Praktis tidak larut:
3) Tugas: mengamati pengaruh sifat pelarut terhadap proses pelarutan zat.
Perintah eksekusi:
Tuang 5 ml alkohol (No. 1) dan 5 ml air (No. 2) ke dalam 2 tabung reaksi yang berisi tembaga sulfat.
tutup sumbatnya dan kocok dengan baik untuk melarutkan zat dengan lebih baik.
Manakah dari pelarut yang diusulkan yang dapat melarutkan tembaga sulfat dengan baik?
Menarik kesimpulan tentang pengaruh sifat pelarut terhadap proses pelarutan dan
kemampuan zat untuk larut dalam pelarut yang berbeda.
Jenis solusi:
Larutan jenuh adalah larutan yang suatu zat tidak lagi larut pada suhu tertentu.
Larutan tak jenuh adalah larutan yang pada suhu tertentu suatu zat masih dapat larut.
Larutan lewat jenuh adalah larutan yang suatu zat masih dapat larut hanya jika suhunya dinaikkan.
Suatu pagi saya ketiduran.
Bersiap ke sekolah dengan cepat:
Saya menuangkan teh dingin,
Gula dituangkan, diaduk,
Tapi rasanya tetap tidak manis.
Saya masih mengisi sendok,
Dia menjadi sedikit lebih manis.
Aku menghabiskan sisa tehku,
Dan sisanya menjadi manis,
Sugar menungguku di bawah!
Saya mulai memikirkannya dalam pikiran saya -
Mengapa takdir tidak disukai?
Pelakunya adalah kelarutan.
Identifikasi jenis solusi dalam puisi tersebut. Apa yang perlu dilakukan agar gula benar-benar larut dalam teh.
Teori larutan fisika-kimia.
Zat terlarut, bila dilarutkan dengan air, membentuk hidrat.
Hidrat adalah senyawa lemah zat dengan air yang ada dalam larutan.
Selama pelarutan, panas diserap atau dilepaskan.
Dengan meningkatnya suhu, kelarutan zat meningkat.
Komposisi hidrat bervariasi dalam larutan dan konstan dalam kristal hidrat.
Kristal hidrat adalah garam yang mengandung air.
Tembaga sulfat CuSO4∙ 5H2O
Soda Na2CO3∙ 10H2O
Gipsum CaSO4∙ 2H2O
Kelarutan kalium klorida dalam air pada suhu 60 0C adalah 50 g. Tentukan fraksi massa garam dalam larutan jenuh pada suhu yang ditentukan.
Tentukan kelarutan kalium sulfat pada 80 0C. Tentukan fraksi massa garam dalam larutan jenuh pada suhu yang ditentukan.
161 g garam Glauber dilarutkan dalam 180 liter air. Tentukan fraksi massa garam dalam larutan yang dihasilkan.
Pekerjaan rumah. Paragraf 35
Pesan.
Sifat air yang luar biasa;
Air adalah senyawa yang paling berharga;
Penggunaan air dalam industri;
Produksi air tawar buatan;
Perjuangan untuk mendapatkan air bersih.
Presentasi “Kristal hidrat”, “Solusi - sifat, aplikasi”.
Beberapa zat larut lebih baik dalam pelarut tertentu, yang lain kurang baik. Dipercaya bahwa tidak ada zat yang benar-benar tidak larut. Setiap zat mampu larut, bahkan dalam beberapa kasus dalam jumlah yang sangat kecil (misalnya merkuri dalam air, benzena dalam air).
Sayangnya, sampai saat ini, belum ada teori yang dapat digunakan untuk memprediksi dan menghitung kelarutan suatu zat dalam pelarut yang bersangkutan. Hal ini disebabkan rumitnya dan beragamnya interaksi antar komponen larutan dan belum adanya teori umum mengenai larutan (terutama yang terkonsentrasi). Dalam hal ini, data yang diperlukan tentang kelarutan zat biasanya diperoleh secara eksperimental.
Kemampuan suatu zat untuk larut paling sering dicirikan secara kuantitatif kelarutan atau koefisien kelarutan (S).
Kelarutan (S) menunjukkan berapa gram suatu zat yang dapat dilarutkan secara maksimal pada kondisi tertentu (suhu, tekanan) dalam 100 g pelarut hingga membentuk larutan jenuh.
Jika perlu, koefisien kelarutan ditentukan untuk jumlah pelarut lain (misalnya, untuk 1000 g, 100 cm 3, 1000 cm 3, dll.).
Menurut kelarutannya, semua zat, tergantung pada sifatnya, dibagi menjadi 3 kelompok: 1) sangat larut; 2) sedikit larut; 3) sukar larut atau tidak larut.
Koefisien kelarutan zat golongan pertama lebih dari 1 g (per 100 g pelarut), untuk zat golongan kedua berada pada kisaran 0,01 - 1,0 g dan untuk zat golongan ketiga S< 0,01 г.
Kelarutan suatu zat dipengaruhi oleh banyak faktor, yang utama adalah sifat pelarut dan zat terlarut, suhu, tekanan, dan keberadaan zat lain (terutama elektrolit) dalam larutan.
Pengaruh sifat zat terhadap kelarutan
Telah ditetapkan secara eksperimental bahwa zat yang dibentuk oleh ikatan polar ionik atau kovalen paling baik larut dalam pelarut yang molekulnya polar. Dan dalam pelarut yang molekulnya nonpolar, zat yang dibentuk oleh ikatan kovalen polar lemah atau nonpolar akan larut lebih baik. Dengan cara lain, pola yang teridentifikasi ini dapat dirumuskan sebagai berikut: “Suka larut menjadi suka.”
Kelarutan suatu zat sangat ditentukan oleh kekuatan dan sifat interaksinya dengan molekul pelarut. Semakin jelas interaksi ini, semakin besar kelarutannya dan sebaliknya.
Diketahui bahwa gaya yang bekerja antara molekul nonpolar dan molekul polar lemah bersifat kecil dan tidak spesifik, yaitu. secara kuantitatif tidak terlalu bergantung pada jenis zatnya.
Jika molekul non-polar A yang sejenis dimasukkan ke dalam cairan non-polar B, maka energi interaksi antara partikel A dan B tidak akan berbeda nyata dengan energi interaksi antara partikel A dan A atau partikel B dan B. Oleh karena itu, sama seperti sejumlah zat yang sama dicampur, dengan kemungkinan besar, berbagai cairan non-polar akan bercampur satu sama lain tanpa batas waktu (yaitu, larut satu sama lain).
Untuk alasan yang sama, kristal molekuler biasanya larut lebih baik dalam cairan non-polar.
Jika energi interaksi molekul A dan A atau B dan B lebih besar dari A dan B, maka molekul identik dari masing-masing komponen akan cenderung berikatan satu sama lain dan kelarutannya satu sama lain akan berkurang (Tabel 6).
Polaritas pelarut apa pun sering kali dicirikan oleh nilai konstanta dielektriknya (ε), yang mudah ditentukan secara eksperimental. Semakin besar, semakin polar zat tersebut.
Tabel 6. Kelarutan KI (wt%) dalam pelarut dengan polaritas berbeda
Hari ini kita akan berbicara tentang zat – air!
Pernahkah di antara Anda melihat air?
Apakah pertanyaan itu tampak konyol bagi Anda? Tapi itu mengacu pada air yang benar-benar murni, di mana tidak ada kotoran. Jika jawaban Anda jujur dan tepat, Anda harus mengakui bahwa baik saya maupun Anda belum pernah melihat air seperti itu. Itulah sebabnya ada tanda tanya pada segelas air setelah tulisan “H 2 O”. Artinya gelas di dalam gelas tersebut bukanlah air murni, lalu bagaimana?
Gas yang terlarut dalam air ini: N2, O2, CO2, Ar, garam dari tanah, kation besi dari pipa air. Selain itu, partikel debu kecil tersuspensi di dalamnya. Itulah yang kami sebut airnya! Banyak ilmuwan berupaya memecahkan masalah sulit dalam memperoleh air yang benar-benar murni. Namun sejauh ini air ultra murni tersebut belum bisa diperoleh. Namun, Anda mungkin berpendapat bahwa ada air sulingan. Ngomong-ngomong, siapa dia?
Kami sebenarnya mendapatkan air ini saat kami mensterilkan stoples sebelum pengalengan. Balikkan stoples dan letakkan di atas air mendidih. Tetesan muncul di dasar toples, ini air suling. Tapi begitu kita membalik toples, gas dari udara masuk ke dalamnya, dan lagi-lagi ada larutan di dalam toples. Oleh karena itu, ibu rumah tangga yang kompeten berusaha mengisi toples dengan isi yang diperlukan segera setelah sterilisasi. Mereka mengatakan bahwa produk dalam hal ini akan disimpan lebih lama. Mungkin mereka benar. Jangan ragu untuk bereksperimen! Justru karena air mampu melarutkan berbagai zat di dalamnya, para ilmuwan masih belum bisa mendapatkan air murni sempurna dalam volume besar. Dan itu akan sangat berguna, misalnya dalam pengobatan untuk menyiapkan obat.
Ngomong-ngomong, saat berada di dalam gelas, air “melarutkan” gelas tersebut. Oleh karena itu, semakin tebal kacanya, maka kacamata tersebut akan bertahan lebih lama. Apa itu air laut?
Ini adalah larutan yang mengandung banyak zat. Misalnya garam meja. Bagaimana cara mengekstrak garam meja dari air laut?
Penguapan. Omong-omong, inilah yang dilakukan nenek moyang kita. Di Onega terdapat pabrik garam tempat garam diuapkan dari air laut. Mereka menjual garam kepada pedagang Novgorod dan membeli perhiasan mahal serta kain mewah untuk calon pengantin. Bahkan para fashionista Moskow pun tidak memiliki pakaian seperti Pomorok. Dan semua itu hanya berkat pengetahuan tentang sifat-sifat larutan! Jadi, hari ini kita berbicara tentang solusi dan kelarutan. Mari kita tuliskan definisi penyelesaiannya di buku catatan kita.
Larutan adalah sistem homogen yang terdiri dari molekul pelarut dan zat terlarut, di mana terjadi interaksi fisik dan kimia.
Mari kita lihat skema 1–2 dan cari tahu solusi apa yang ada.
Solusi mana yang Anda sukai saat menyiapkan sup? Mengapa?
Tentukan letak larutan encer dan larutan pekat tembaga sulfat?
Jika suatu larutan dengan volume tertentu mengandung sedikit zat terlarut, maka larutan tersebut disebut encer, jika ada banyak – pekat
.
Tentukan solusi yang mana?
Konsep larutan “jenuh” dan “pekat”, larutan “tak jenuh” dan “encer” tidak boleh tertukar.
Ada zat yang larut dengan baik dalam air, ada yang sedikit larut, dan ada pula yang tidak larut sama sekali. Tonton video "PADAT PADAT DALAM AIR"
Selesaikan tugas di buku catatan Anda: Bagikan zat yang diusulkan -BERSAMA 2 , H 2 , O 2 , H 2 SO 4 , Cuka, NaCl, Kapur, Karat, Minyak sayur, Alkoholke dalam kolom kosong Tabel 1, menggunakan pengalaman hidup Anda.
Tabel 1
|
Larut |
Contoh zat |
|
|
Larut |
Sedikit larut |
|
|
Gas |
||
|
Cairan |
||
|
Padat |
||
Bisakah Anda berbicara tentang kelarutan? FeSO4?
Bagaimana ini bisa terjadi?
Untuk menentukan kelarutan suatu zat dalam air, kita akan menggunakan tabel kelarutan garam, asam dan basa dalam air. Itu ada di lampiran pelajaran.
Di baris atas tabel ada kation, di kolom kiri ada anion; kita mencari titik potongnya, lihat hurufnya - ini kelarutan.
Mari kita tentukan kelarutan garam: AgNO3, AgCl, CaSO4.
Kelarutan meningkat seiring dengan meningkatnya suhu (ada pengecualian). Anda tahu betul bahwa lebih mudah dan cepat melarutkan gula dalam air panas daripada air dingin. Saksikan "Fenomena Termal dalam Pelarutan"
Cobalah sendiri menggunakan tabel untuk menentukan kelarutan suatu zat.
Latihan. Tentukan kelarutan zat-zat berikut: AgNO 3, Fe(OH) 2, Ag 2 SO 3, Ca(OH) 2, CaCO 3, MgCO 3, KOH.
DEFINISI pada topik “Solusi”
Larutan- sistem homogen yang terdiri dari molekul pelarut dan zat terlarut, di antaranya terjadi interaksi fisik dan kimia.
Solusi jenuh - larutan di mana suatu zat tidak lagi larut pada suhu tertentu.
Solusi tak jenuh - larutan yang pada suhu tertentu suatu zat masih dapat larut.
Penangguhandisebut suspensi di mana partikel-partikel kecil zat padat didistribusikan secara merata di antara molekul-molekul air.
Emulsidisebut suspensi di mana tetesan kecil suatu cairan didistribusikan di antara molekul-molekul cairan lain.
Larutan encer - larutan dengan sedikit kandungan zat terlarut.
Solusi terkonsentrasi - larutan dengan kandungan zat terlarut yang tinggi.
TAMBAHAN:
Berdasarkan perbandingan dominasi jumlah partikel yang masuk ke dalam larutan atau keluar dari larutan, larutan dibedakan jenuh, tidak jenuh, dan lewat jenuh. Berdasarkan jumlah relatif zat terlarut dan pelarut, larutan dibedakan menjadi encer dan pekat.
Suatu larutan dimana zat tertentu tidak lagi larut pada suhu tertentu, mis. larutan yang berada dalam kesetimbangan dengan zat terlarut disebut kaya, dan larutan yang masih dapat melarutkan sejumlah tambahan zat tertentu adalah tak jenuh.
Suatu larutan jenuh mengandung jumlah zat terlarut maksimum (untuk kondisi tertentu). Oleh karena itu, larutan jenuh adalah larutan yang berada dalam kesetimbangan dengan zat terlarut berlebih. Konsentrasi larutan jenuh (kelarutan) suatu zat tertentu dalam kondisi yang ditentukan secara ketat (suhu, pelarut) adalah nilai konstan.
Suatu larutan yang mengandung lebih banyak zat terlarut daripada yang seharusnya ada dalam larutan jenuh pada kondisi tertentu disebut terlalu jenuh. Larutan lewat jenuh adalah sistem yang tidak stabil dan tidak setimbang di mana terjadi transisi spontan ke keadaan setimbang. Ini melepaskan kelebihan zat terlarut dan larutan menjadi jenuh.
Larutan jenuh dan tak jenuh berbeda dengan larutan encer dan pekat. Larutan encer- larutan dengan sedikit kandungan zat terlarut; solusi terkonsentrasi- larutan dengan kandungan zat terlarut yang tinggi. Harus ditekankan bahwa konsep larutan encer dan pekat adalah relatif, hanya menyatakan perbandingan jumlah zat terlarut dan pelarut dalam larutan.Sains ke teknologi. Air yang tersebar luas di alam selalu mengandung zat-zat terlarut. Jumlahnya sedikit di air tawar sungai dan danau, sedangkan air laut mengandung sekitar 3,6% garam terlarut.
Di lautan purba (selama munculnya kehidupan di Bumi), fraksi massa garam diasumsikan rendah, sekitar 1%.
Dalam larutan inilah organisme hidup pertama kali berkembang, dan dari larutan inilah mereka menerima zat dan molekul yang diperlukan untuk pertumbuhan dan kehidupannya... Seiring waktu, organisme hidup berkembang dan berubah. APA yang memungkinkan mereka meninggalkan lingkungan perairan dan berpindah ke darat lalu naik ke udara. Mereka memperoleh kemampuan ini, dan tubuh mereka mempertahankan larutan berair dalam bentuk cairan yang mengandung pasokan ion dan molekul yang diperlukan” - beginilah cara ahli kimia Amerika terkenal, pemenang Hadiah Nobel Linus Pauling mengevaluasi peran larutan dalam kemunculan dan perkembangannya. kehidupan di Bumi. Di dalam diri kita, di setiap sel Anda – kenangan akan lautan utama tempat kehidupan berasal – larutan air yang menghasilkan kehidupan itu sendiri.
Dalam setiap organisme hidup, larutan ajaib yang menjadi dasar darah mengalir tanpa henti melalui pembuluh - arteri, vena, dan kapiler, fraksi massa garam di dalamnya sama dengan di lautan primer; - 0,0%. Proses fisik dan kimia kompleks yang terjadi pada tubuh manusia dan hewan juga terjadi dalam larutan. Penyerapan makanan berhubungan dengan transfer nutrisi ke dalam larutan. Larutan berair alami berpartisipasi dalam proses pembentukan tanah dan memasok nutrisi bagi tanaman. Banyak proses teknologi dalam industri kimia dan industri lainnya, misalnya produksi soda, pupuk, asam, logam, dan kertas, berlangsung dalam larutan. Studi tentang sifat-sifat larutan menempati tempat yang sangat penting dalam ilmu pengetahuan modern. Jadi apa solusinya?
Perbedaan antara larutan dan campuran lainnya adalah ini. bahwa partikel-partikel penyusunnya terdistribusi secara merata di dalamnya, dan dalam setiap mikrovolume campuran tersebut komposisinya sama.
Itu sebabnya solusi yang dimaksud campuran homogen yang terdiri dari dua atau lebih bagian homogen. Ide ini didasarkan pada teori fisika solusi.
Para pendukung teori fisika larutan, yang dikembangkan oleh Van't Hoff, Lawrence dan Ostwald, percaya bahwa proses pelarutan adalah hasil difusi, yaitu penetrasi zat terlarut ke dalam ruang antar molekul air.
Berbeda dengan gagasan teori fisika tentang larutan. D. I. Mendeleev dan pendukung teori kimia larutan membuktikan bahwa pembubaran adalah hasil interaksi kimia suatu zat terlarut dengan molekul air. Oleh karena itu, lebih tepat (lebih tepat) untuk mendefinisikan larutan sebagai suatu sistem homogen yang terdiri dari partikel-partikel zat terlarut, pelarut, dan produk interaksinya.
Sebagai hasil interaksi kimia suatu zat terlarut dengan air, terbentuk senyawa hidrat. Interaksi kimia ditunjukkan dengan tanda-tanda reaksi kimia seperti fenomena termal selama pelarutan. Misalnya, ingatlah bahwa pelarutan asam sulfat dalam air melepaskan panas dalam jumlah besar sehingga larutan dapat mendidih, sehingga asam tersebut dituangkan ke dalam air (dan bukan sebaliknya). Pelarutan zat lain, seperti natrium klorida dan amonium nitrat, disertai dengan penyerapan panas.
Isi pelajaran catatan pelajaran kerangka pendukung metode percepatan penyajian pelajaran teknologi interaktif Praktik tugas dan latihan lokakarya tes mandiri, pelatihan, kasus, pencarian pekerjaan rumah, pertanyaan diskusi, pertanyaan retoris dari siswa Ilustrasi audio, klip video dan multimedia foto, gambar, grafik, tabel, diagram, humor, anekdot, lelucon, komik, perumpamaan, ucapan, teka-teki silang, kutipan Pengaya abstrak artikel trik untuk boks penasaran buku teks kamus dasar dan tambahan istilah lainnya Menyempurnakan buku teks dan pelajaranmemperbaiki kesalahan dalam buku teks pemutakhiran suatu penggalan dalam buku teks, unsur inovasi dalam pembelajaran, penggantian pengetahuan yang sudah ketinggalan zaman dengan yang baru Hanya untuk guru pelajaran yang sempurna rencana kalender untuk tahun ini; rekomendasi metodologis; Pelajaran Terintegrasi