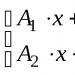Artikel ini membahas konsep seperti fraksi massa. Metode untuk menghitungnya diberikan. Definisi besaran yang serupa bunyinya tetapi berbeda arti fisisnya juga dijelaskan. Ini adalah fraksi massa untuk unsur dan hasil.
Tempat lahir kehidupan - solusi
Air adalah sumber kehidupan di planet biru kita yang indah. Ungkapan ini cukup sering kita jumpai. Namun, hanya sedikit orang, kecuali para ahli, yang berpikir: sebenarnya, substrat untuk pengembangan yang pertama sistem biologis menjadi larutan zat, bukan secara kimia air bersih. Pastinya pembaca pernah menjumpai ungkapan “kaldu primordial” dalam literatur atau program populer.
Tentang sumber-sumber yang memberi dorongan terhadap perkembangan kehidupan yang berbentuk kompleks molekul organik, masih berdebat. Beberapa orang bahkan menyarankan bukan hanya suatu kebetulan alami dan sangat menguntungkan, namun intervensi kosmik. Lebih-lebih lagi yang sedang kita bicarakan sama sekali bukan tentang mitos alien, tapi tentang kondisi tertentu untuk menciptakan molekul-molekul yang hanya bisa ada di permukaan kecil benda kosmik tanpa atmosfer - komet dan asteroid. Oleh karena itu, akan lebih tepat jika dikatakan bahwa larutan molekul organik adalah tempat lahirnya semua makhluk hidup.
Air sebagai zat yang murni secara kimia
Meskipun lautan dan lautan sangat asin, danau dan sungai segar, secara kimiawi bentuk murni air sangat jarang ditemukan, terutama di laboratorium khusus. Mari kita ingat kembali hal itu dalam tradisi ilmiah dalam negeri secara kimia zat murni- ini adalah zat yang mengandung tidak lebih dari sepuluh pangkat minus enam dari fraksi massa pengotor.

Memperoleh massa yang benar-benar bebas dari komponen asing membutuhkan biaya yang luar biasa dan jarang dapat dibenarkan. Ini hanya digunakan di industri tertentu, di mana satu atom asing pun dapat merusak eksperimen. Perlu diperhatikan bahwa elemen semikonduktor, yang menjadi dasar teknologi mini saat ini (termasuk ponsel pintar dan tablet), sangat sensitif terhadap kotoran. Dalam pembuatannya, diperlukan pelarut yang benar-benar tidak terkontaminasi. Namun, dibandingkan dengan seluruh cairan di planet ini, hal ini dapat diabaikan. Mengapa air yang tersebar luas di planet kita begitu jarang ditemukan dalam bentuk murni? Kami akan menjelaskannya sedikit di bawah ini.
Pelarut ideal
Membalas pertanyaan yang diajukan di bagian sebelumnya pertanyaannya sangat sederhana. Air punya molekul polar. Artinya dalam setiap partikel terkecil Kutub positif dan negatif cairan ini tidak terpisah jauh, melainkan terpisah. Dalam hal ini, struktur yang muncul bahkan dalam air cair menciptakan ikatan tambahan (yang disebut hidrogen). Dan masuk total ini memberikan hasil sebagai berikut. Suatu zat yang memasuki air (berapa pun muatannya) ditarik terpisah oleh molekul-molekul cairan. Setiap partikel pengotor terlarut diselimuti oleh negatif atau aspek positif molekul air. Dengan demikian, cairan unik ini mampu larut dengan sangat baik jumlah besar berbagai macam zat.

Konsep fraksi massa dalam larutan
Solusi yang dihasilkan mengandung beberapa pengotor, yang disebut “fraksi massa”. Meski ungkapan ini tidak sering muncul. Istilah lain yang biasa digunakan adalah “konsentrasi”. Fraksi massa ditentukan oleh perbandingan tertentu. Kami tidak akan memberikan rumusan rumusnya, cukup sederhana, mari kita jelaskan arti fisisnya. Ini adalah rasio dua massa - pengotor terhadap larutan. Fraksi massa adalah besaran yang tidak berdimensi. Dinyatakan secara berbeda tergantung pada tugas tertentu. Artinya, dalam pecahan suatu satuan, jika rumusnya hanya berisi perbandingan massa, dan dalam persentase - jika hasilnya dikalikan 100%.
Kelarutan
Selain H 2 O, pelarut lain juga digunakan. Selain itu, ada zat yang pada dasarnya tidak menyerahkan molekulnya kepada air. Tapi mereka mudah larut dalam bensin atau asam sulfat panas.

Ada tabel khusus yang menunjukkan berapa banyak bahan tertentu yang tersisa di dalam cairan. Indikator ini disebut kelarutan dan bergantung pada suhu. Semakin tinggi, semakin aktif atom atau molekul pelarut bergerak, dan semakin banyak pengotor yang mampu diserapnya.
Pilihan untuk menentukan proporsi zat terlarut dalam suatu larutan
Karena tugas ahli kimia dan teknolog, serta insinyur dan fisikawan, mungkin berbeda, maka bagian zat terlarut dalam air ditentukan secara berbeda. Fraksi volume dihitung sebagai volume pengotor terhadap total volume larutan. Parameter yang berbeda digunakan, namun prinsipnya tetap sama.
Fraksi volume tetap tidak berdimensi, dinyatakan sebagai pecahan satuan atau persentase. Molaritas (juga disebut “konsentrasi volume molar”) adalah jumlah mol zat terlarut dalam volume larutan tertentu. Definisi ini sudah melibatkan dua parameter berbeda dari satu sistem, dan dimensi besaran ini berbeda. Hal ini dinyatakan dalam mol per liter. Untuk berjaga-jaga, mari kita ingat bahwa satu mol adalah jumlah suatu zat yang mengandung kira-kira sepuluh hingga dua puluh tiga pangkat molekul atau atom.
Konsep fraksi massa suatu unsur
Nilai ini hanya berhubungan secara tidak langsung dengan solusi. Fraksi massa suatu unsur berbeda dengan konsep yang dibahas di atas. Kompleks apa pun senyawa kimia terdiri dari dua atau lebih elemen. Setiap orang memiliki miliknya sendiri massa relatif. Nilai ini dapat ditemukan di sistem kimia Mendeleev. Di sana ditunjukkan dalam angka bukan bilangan bulat, tetapi untuk masalah perkiraan, nilainya dapat dibulatkan. Termasuk zat kompleks mengandung sejumlah atom dari masing-masing jenis. Misalnya dalam air (H 2 O) terdapat dua atom hidrogen dan satu oksigen. Perbandingan antara massa relatif seluruh zat dan suatu unsur tertentu sebagai persentase akan menjadi fraksi massa unsur tersebut.

Bagi pembaca yang belum berpengalaman, kedua konsep ini mungkin tampak dekat. Dan seringkali mereka bingung satu sama lain. Fraksi massa hasil tidak mengacu pada larutan, namun pada reaksi. Setiap proses kimia selalu dilanjutkan dengan produksi produk tertentu. Hasil mereka dihitung menggunakan rumus tergantung pada reaktan dan kondisi proses. Berbeda dengan fraksi massa, nilai ini tidak mudah ditentukan. Perhitungan teoritis mengasumsikan jumlah zat maksimum yang mungkin dalam produk reaksi. Namun, latihan selalu memberi sedikit nilai yang lebih rendah. Alasan perbedaan ini terletak pada distribusi energi di antara molekul-molekul yang sangat panas sekalipun.

Dengan demikian, akan selalu ada partikel “terdingin” yang tidak dapat bereaksi dan tetap dalam keadaan semula. Arti fisik Fraksi massa rendemen adalah berapa persentase zat yang sebenarnya diperoleh dari zat yang dihitung secara teoritis. Rumusnya sangat sederhana. Massa produk yang diperoleh secara praktis dibagi dengan massa produk yang dihitung secara praktis, dan seluruh ekspresi dikalikan dengan seratus persen. Fraksi massa hasil ditentukan oleh jumlah mol reaktan. Jangan lupakan ini. Faktanya adalah satu mol suatu zat adalah sejumlah atom atau molekul tertentu. Menurut hukum kekekalan materi, dua puluh molekul air tidak dapat menghasilkan tiga puluh molekul asam sulfat, sehingga permasalahannya dihitung seperti ini. Dari jumlah mol komponen awal, diperoleh massa yang secara teoritis memungkinkan untuk menghasilkan hasil. Kemudian, dengan mengetahui berapa banyak produk reaksi yang sebenarnya dihasilkan, fraksi massa hasil ditentukan dengan menggunakan rumus yang dijelaskan di atas.
Dari mata kuliah kimia kita mengetahui bahwa fraksi massa adalah kandungan unsur tertentu dalam suatu zat. Tampaknya pengetahuan seperti itu tidak berguna bagi penghuni musim panas biasa. Namun jangan terburu-buru menutup halaman ini, karena kemampuan menghitung fraksi massa bagi seorang tukang kebun bisa sangat berguna. Namun agar tidak bingung, mari kita bahas semuanya secara urut.Apa inti dari konsep “fraksi massa”?
Fraksi massa diukur dalam persentase atau hanya dalam sepersepuluh. Tepat di atas kita bicarakan definisi klasik, yang dapat ditemukan di buku referensi, ensiklopedia atau buku pelajaran kimia sekolah. Namun memahami inti dari apa yang telah dikatakan tidaklah mudah. Jadi, misalkan kita mempunyai 500 g suatu zat kompleks. Sulit masuk dalam hal ini berarti komposisinya tidak homogen. Pada umumnya, zat apa pun yang kita gunakan adalah garam meja yang kompleks, bahkan yang sederhana, yang rumusnya adalah NaCl, yaitu terdiri dari molekul natrium dan klor. Jika kita melanjutkan alasan kita dengan menggunakan contoh garam meja, maka kita asumsikan 500 gram garam mengandung 400 gram natrium. Maka fraksi massanya menjadi 80% atau 0,8.
Mengapa penghuni musim panas membutuhkan ini?
Saya rasa Anda sudah tahu jawaban atas pertanyaan ini. Persiapan semua jenis larutan, campuran, dll. merupakan bagian yang tidak terpisahkan aktivitas ekonomi tukang kebun mana pun. Pupuk, berbagai campuran unsur hara, serta obat lain, misalnya perangsang tumbuh “Epin”, “Kornevin”, dll digunakan dalam bentuk larutan. Selain itu, sering kali perlu mencampur bahan kering seperti semen, pasir, dan komponen lainnya, atau tanah kebun biasa dengan substrat yang dibeli. Pada saat yang sama, konsentrasi yang direkomendasikan dari bahan dan obat ini dalam larutan atau campuran yang disiapkan di sebagian besar instruksi diberikan dalam fraksi massa.
Oleh karena itu, mengetahui cara menghitung fraksi massa suatu unsur dalam suatu zat akan membantu penghuni musim panas mempersiapkan dengan benar larutan pupuk atau campuran unsur hara yang diperlukan, dan hal ini, pada gilirannya, tentu akan mempengaruhi panen di masa depan.
Algoritma perhitungan
Jadi, fraksi massa suatu komponen adalah perbandingan massanya dengan massa total larutan atau zat. Jika hasil yang diperoleh perlu diubah menjadi persentase, maka harus dikalikan dengan 100. Dengan demikian, rumus menghitung fraksi massa dapat dituliskan sebagai berikut:
W = Massa zat / Massa larutan
W = (Massa zat / Massa larutan) x 100%.
Contoh penentuan fraksi massa
Misalkan kita mempunyai larutan yang untuk pembuatannya ditambahkan 5 g NaCl ke dalam 100 ml air, dan sekarang kita perlu menghitung konsentrasi garam meja, yaitu fraksi massanya. Kita mengetahui massa suatu zat, dan massa larutan yang dihasilkan adalah jumlah dari dua massa - garam dan air dan sama dengan 105 g. Jadi, kita bagi 5 g dengan 105 g, kalikan hasilnya dengan 100 dan dapatkan nilai yang diinginkan sebesar 4,7%. Inilah konsentrasi yang akan dimiliki air garam.
Tugas yang lebih praktis
Dalam praktiknya, penghuni musim panas sering kali harus menghadapi berbagai jenis masalah. Misalnya, perlu menyiapkan larutan pupuk tertentu, yang konsentrasinya menurut beratnya harus 10%. Untuk mematuhi proporsi yang disarankan secara akurat, Anda perlu menentukan berapa banyak zat yang dibutuhkan dan berapa volume air yang perlu dilarutkan.
Pemecahan masalah dimulai dari urutan terbalik. Pertama, Anda harus membagi fraksi massa yang dinyatakan sebagai persentase dengan 100. Hasilnya, kita memperoleh W = 0,1 - ini adalah fraksi massa suatu zat dalam satuan. Sekarang mari kita nyatakan jumlah zat sebagai x, dan massa akhir larutan sebagai M. Dalam hal ini, nilai terakhir terdiri dari dua suku - massa air dan massa pupuk. Artinya, M = Mv + x. Jadi kita mendapatkan persamaan sederhana:
L = x / (Mw + x)
Menyelesaikannya untuk x, kita mendapatkan:
x = L x Mv / (1 – L)
Mengganti data yang tersedia, kami memperoleh hubungan berikut:
x = 0,1 x MV / 0,9
Jadi, jika kita mengambil 1 liter (yaitu 1000 g) air untuk membuat larutan, maka untuk menyiapkan larutan dengan konsentrasi yang dibutuhkan kita membutuhkan sekitar 111-112 g pupuk.
Memecahkan masalah pengenceran atau penambahan
Misalkan kita mempunyai 10 liter (10.000 g) bahan jadi larutan berair dengan konsentrasi zat tertentu di dalamnya W1 = 30% atau 0,3. Berapa banyak air yang perlu ditambahkan ke dalamnya untuk menurunkan konsentrasinya menjadi W2 = 15% atau 0,15? Dalam hal ini, rumusnya akan membantu:
= (W1х М1 / W2) – М1
Mengganti data awal, kami menemukan bahwa jumlah air yang ditambahkan seharusnya:
Mv = (0,3 x 10.000 / 0,15) – 10.000 = 10.000 g
Artinya, Anda perlu menambahkan 10 liter yang sama.
Sekarang bayangkan soal kebalikannya - ada 10 liter larutan berair (M1 = 10.000 g) dengan konsentrasi W1 = 10% atau 0,1. Anda perlu mendapatkan larutan dengan fraksi massa pupuk W2 = 20% atau 0,2. Berapa banyak bahan awal yang perlu ditambahkan? Untuk melakukan ini, Anda perlu menggunakan rumus:
x = M1 x (W2 – W1) / (1 – W2)
Mengganti nilai asli, kita mendapatkan x = 1,125 g.
Jadi, pengetahuan tentang dasar-dasar paling sederhana kimia sekolah akan membantu tukang kebun menyiapkan larutan pupuk, substrat nutrisi dari beberapa elemen atau campuran dengan benar untuk pekerjaan konstruksi.
Fraksi massa suatu unsur ω(E)% adalah perbandingan massa suatu unsur m (E) dalam suatu molekul suatu zat dengan massa molekul zat tersebut Mr (in-va).
Fraksi massa suatu unsur dinyatakan dalam pecahan satuan atau persentase:
ω(E) = m (E) / Mr(in-va) (1)
ω% (E) = m(E) 100%/Mr(in-va)
Jumlah pecahan massa seluruh unsur materi sama dengan 1 atau 100%.
Biasanya, untuk menghitung fraksi massa suatu unsur, mereka mengambil sebagian zat sama dengan massa molar zat tersebut, kemudian massa suatu unsur dalam porsi tersebut sama dengan massa molarnya dikalikan dengan bilangan. atom suatu unsur tertentu dalam molekul.
Jadi, untuk suatu zat A x B y dalam pecahan kesatuan:
ω(A) = Ar(E) X / Мr(in-va) (2)
Dari proporsi (2) kita peroleh rumus perhitungan untuk menentukan indeks (x, y) dalam rumus kimia suatu zat, jika fraksi massa kedua unsur dan massa molar zat tersebut diketahui:
X = ω%(A) Mr(in-va) / Ar(E) 100% (3)
Membagi ω% (A) dengan ω% (B), mis. mengubah rumus (2), kita memperoleh:
ω(A) / ω(B) = X Ar(A) / Y Ar(B) (4)
Rumus perhitungan (4) dapat diubah sebagai berikut:
X: Y = ω%(A) / Ar(A) : ω%(B) / Ar(B) = X(A) : Y(B) (5)
Rumus hitung (3) dan (5) digunakan untuk menentukan rumus suatu zat.
Jika jumlah atom dalam molekul suatu zat untuk salah satu unsur dan fraksi massanya diketahui, kita dapat menentukannya massa molar zat:
Tuan(v-va) = Ar(E) X / W(A)
Contoh penyelesaian masalah penghitungan fraksi massa unsur kimia dalam suatu zat kompleks
Perhitungan fraksi massa unsur kimia dalam suatu zat yang kompleks
Contoh 1. Tentukan fraksi massa unsur kimia dalam asam sulfat H 2 SO 4 dan nyatakan dalam persentase.
Larutan
1. Hitung berat molekul relatif asam sulfat:
Tuan (H 2 SO 4) = 1 2 + 32 + 16 4 = 98
2. Hitung fraksi massa unsur.
Untuk ini nilai numerik Massa suatu unsur (termasuk indeks) dibagi dengan massa molar suatu zat:
Dengan memperhatikan hal ini dan menyatakan fraksi massa suatu unsur dengan huruf ω, perhitungan fraksi massa dilakukan sebagai berikut:
ω(H) = 2: 98 = 0,0204, atau 2,04%;
ω(S) = 32 : 98 = 0,3265 atau 32,65%;
ω(O) = 64: 98 =0,6531, atau 65,31%
Contoh 2. Tentukan fraksi massa unsur kimia dalam aluminium oksida Al 2 O 3 dan nyatakan dalam persentase.
Larutan
1. Hitung berat molekul relatif aluminium oksida:
Tuan(Al 2 O 3) = 27 2 + 16 3 = 102
2. Hitung fraksi massa unsur:
ω(Al) = 54: 102 = 0,53 = 53%
ω(O) = 48: 102 = 0,47 = 47%
Cara menghitung fraksi massa suatu zat dalam kristal hidrat
Fraksi massa suatu zat adalah perbandingan massa suatu zat dalam suatu sistem dengan massa seluruh sistem, yaitu. ω(X) = m(X) / m,
dimana ω(X) adalah fraksi massa zat X,
m(X) - massa zat X,
m - massa seluruh sistem
Fraksi massa adalah besaran yang tidak berdimensi. Ini dinyatakan sebagai pecahan satuan atau persentase.
Contoh 1. Tentukan fraksi massa air kristalisasi dalam barium klorida dihidrat BaCl 2 2H 2 O.
Larutan
Massa molar BaCl 2 2H 2 O adalah:
M(BaCl 2 2H 2 O) = 137+ 2 35,5 + 2 18 = 244 g/mol
Dari rumus BaCl 2 2H 2 O maka 1 mol barium klorida dihidrat mengandung 2 mol H 2 O. Dari sini kita dapat menentukan massa air yang terkandung dalam BaCl 2 2H 2 O:
m(H2O) = 2 18 = 36 gram.
Kami menemukan fraksi massa air kristalisasi dalam barium klorida dihidrat BaCl 2 2H 2 O.
ω(H 2 O) = m(H 2 O)/m(BaCl 2 2H 2 O) = 36 / 244 = 0,1475 = 14,75%.
Contoh 2. Dari sampel batu seberat 25 g, mengandung mineral argentit Ag 2 S, perak seberat 5,4 g diisolasi. Tentukan fraksi massa argentit dalam sampel.
|
|
Kami menentukan jumlah zat perak yang ditemukan di argentit: n(Ag) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 mol. Dari rumus Ag 2 S diketahui bahwa jumlah zat argentit adalah setengah jumlah zat perak. Tentukan jumlah zat argentit: n(Ag 2 S) = 0,5 n(Ag) = 0,5 · 0,05 = 0,025 mol Kami menghitung massa argentit: m(Ag 2 S) = n(Ag 2 S) M(Ag2S) = 0,025 248 = 6,2 gram. Sekarang kita menentukan fraksi massa argentit dalam sampel batuan dengan berat 25 g. ω(Ag 2 S) = m(Ag 2 S) / m = 6,2/25 = 0,248 = 24,8%. |