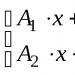Entalpi(dari bahasa Yunani entalpo- panas) adalah sifat suatu zat yang menunjukkan jumlah energi yang dapat diubah menjadi panas.
Entalpi- Ini properti termodinamika suatu zat, yang menunjukkan tingkat energi yang tersimpan dalam struktur molekulnya. Artinya meskipun suatu zat dapat mempunyai energi berdasarkan suhu dan tekanan, tidak semuanya dapat diubah menjadi panas. Sebagian energi dalam selalu tersimpan dalam suatu zat dan mempertahankan struktur molekulnya. Sebagian energi kinetik suatu zat tidak tersedia ketika suhunya mendekati suhu tersebut lingkungan. Karena itu, entalpi adalah jumlah energi yang tersedia untuk diubah menjadi panas pada suhu dan tekanan tertentu.
Satuan entalpi adalah satuan termal British atau Joule untuk energi dan Btu/lbm atau J/kg untuk energi spesifik.
Kuantitas entalpi
Besarnya entalpi suatu zat didasarkan pada suhu tertentu.
Suhu ini- inilah nilai yang dipilih oleh para ilmuwan dan insinyur sebagai dasar perhitungan. Ini adalah suhu di mana entalpi suatu zat adalah nol J. Dengan kata lain, zat tersebut tidak memiliki energi yang dapat diubah menjadi panas. Suhu ini adalah berbagai zat berbeda. Misalnya, suhu air ini adalah titik tripel (0°C), nitrogen -150°C, dan zat pendingin berbasis metana dan etana -40°C.
Jika suhu suatu zat lebih tinggi dari suhu tertentu atau berubah wujud menjadi gas pada suhu tertentu, entalpi dinyatakan sebagai bilangan positif. Sebaliknya, pada suhu di bawah entalpi suatu zat dinyatakan angka negatif. Entalpi digunakan dalam perhitungan untuk menentukan perbedaan tingkat energi antara dua keadaan. Hal ini diperlukan untuk mengkonfigurasi peralatan dan menentukan efisiensi proses.
Entalpi sering didefinisikan sebagai energi total suatu zat, karena sama dengan jumlah energi internal (dan) dalam negara bagian ini beserta kemampuannya dalam menyelesaikan pekerjaan ( hal ). Namun kenyataannya, entalpi tidak menunjukkan energi total suatu zat pada suhu tertentu di atas nol mutlak (-273°C). Oleh karena itu, daripada mendefinisikan entalpi sebagai panas total suatu zat, entalpi lebih tepat didefinisikan sebagai jumlah keseluruhan energi yang tersedia suatu zat yang dapat diubah menjadi panas.
H = U + pV ,Di mana V- volume sistem. Diferensial penuh entalpi mempunyai bentuk:
dH = TdS + VdpSelama reaksi kimia, panas diserap atau dilepaskan ke lingkungan. Pertukaran panas antara reaksi kimia dan lingkungannya disebut entalpi, atau H. Namun, entalpi tidak dapat diukur secara langsung, sehingga perubahan suhu lingkungan (dilambangkan dengan ∆H) biasanya dihitung. ∆H menunjukkan bahwa selama reaksi kimia panas dilepaskan ke lingkungan (reaksi eksotermik) atau panas diserap (reaksi endotermik). Entalpi dihitung sebagai berikut: ∆H = m x s x ∆T, dimana m adalah massa reaktan, s adalah kapasitas panas produk reaksi, ∆T adalah perubahan suhu akibat reaksi.
Tangga
Memecahkan masalah entalpi
- Misalnya, perlu mencari entalpi reaksi pembentukan air dari hidrogen dan oksigen: 2H 2 (hidrogen) + O 2 (oksigen) → 2H 2 O (air). Dalam reaksi ini jam 2 Dan O2- reagen, dan H2O- produk reaksi.
-
Tentukan massa total reagen. Selanjutnya, Anda perlu menghitung massa reaktan. Jika Anda tidak dapat menimbangnya, hitung berat molekulnya untuk mendapatkan berat molekul sebenarnya. Berat molekul adalah konstanta yang dapat ditemukan tabel periodik Tabel periodik atau tabel molekul dan senyawa lainnya. Kalikan massa masing-masing reaktan dengan jumlah mol.
- Dalam contoh kita, reaktan yang dimiliki hidrogen dan oksigen berat molekul masing-masing 2 gram dan 32 gram. Karena kita menggunakan 2 mol hidrogen (koefisien reaksi kimia sebelum hidrogen H2) dan 1 mol oksigen (tidak ada koefisien sebelum O2 berarti 1 mol), maka massa total reagen dihitung sebagai berikut:
2 × (2 gram) + 1 × (32 gram) = 4 gram + 32 gram = 36 gram
- Dalam contoh kita, reaktan yang dimiliki hidrogen dan oksigen berat molekul masing-masing 2 gram dan 32 gram. Karena kita menggunakan 2 mol hidrogen (koefisien reaksi kimia sebelum hidrogen H2) dan 1 mol oksigen (tidak ada koefisien sebelum O2 berarti 1 mol), maka massa total reagen dihitung sebagai berikut:
-
Tentukan kapasitas panas produk. Selanjutnya, tentukan kapasitas panas produk reaksi. Setiap molekul mempunyai kapasitas panas tertentu yang konstan. Temukan konstanta ini dalam tabel di buku teks kimia Anda. Ada beberapa satuan untuk mengukur kapasitas panas; dalam perhitungan kita akan menggunakan J/g°C.
- Perhatikan bahwa jika Anda memiliki beberapa produk reaksi, Anda perlu menghitung kapasitas panas masing-masing produk dan kemudian menjumlahkannya untuk mendapatkan entalpi keseluruhan reaksi.
- Dalam contoh kita, produk reaksinya adalah air yang mempunyai kapasitas panas 4,2 J/g°C.
-
Temukan perubahan suhu. Sekarang kita akan mencari ∆T - perbedaan suhu sebelum dan sesudah reaksi. Dari suhu awal (T1), kurangi suhu akhir (T2). Skala Kelvin (K) paling sering digunakan dalam soal kimia (walaupun skala Celsius (°C) akan memberikan hasil yang sama).
- Dalam contoh kita, asumsikan suhu awal reaksi adalah 185 K, dan setelah reaksi menjadi 95 K, artinya ∆T dihitung sebagai berikut:
∆T = T2 – T1 = 95 K - 185 K = -90K
- Dalam contoh kita, asumsikan suhu awal reaksi adalah 185 K, dan setelah reaksi menjadi 95 K, artinya ∆T dihitung sebagai berikut:
-
Cari entalpinya menggunakan rumus ∆H = M X S x ∆T. Jika m adalah massa reaktan, s adalah kapasitas panas produk reaksi, dan ∆T adalah perubahan suhu, maka entalpi reaksi dapat dihitung. Substitusikan nilainya ke dalam rumus ∆H = M X S x ∆T dan dapatkan entalpinya. Hasilnya dihitung dalam Joule (J).
- Dalam contoh kita, entalpi dihitung sebagai berikut:
∆H = (36 g) × (4,2 JK - 1 g - 1) × (-90 K) = -13608J
- Dalam contoh kita, entalpi dihitung sebagai berikut:
-
Tentukan apakah energi dilepaskan atau diserap selama reaksi tersebut. Salah satu alasan paling umum untuk menghitung ∆H dalam praktiknya adalah untuk mengetahui apakah suatu reaksi akan bersifat eksotermik (melepaskan panas dan mengurangi energinya sendiri) atau endotermik (menyerap panas dari lingkungan dan meningkatkan energinya sendiri). Jika nilai ∆H positif, maka reaksinya bersifat endotermik. Jika negatif, maka reaksinya eksotermik. Semakin besar nilai absolut ∆H, maka lebih banyak energi dilepaskan atau diserap. Berhati-hatilah jika Anda berencana untuk melakukan pengalaman praktis: selama reaksi dengan nilai tinggi entalpi, pelepasan energi dalam jumlah besar dapat terjadi, dan jika terjadi dengan cepat dapat menyebabkan ledakan.
- Dalam contoh kita hasil akhir ternyata sama dengan -13608 J. Terdapat tanda negatif di depan nilai entalpi yang berarti reaksinya eksotermik. Gas panas (dalam bentuk uap) H 2 dan O 2 harus melepaskan sejumlah panas untuk membentuk molekul air, yaitu reaksi pembentukan H 2 O bersifat eksotermik.
Estimasi Entalpi
-
Hitung energi ikatan untuk memperkirakan entalpi. Hampir semua reaksi kimia menyebabkan putusnya beberapa ikatan dan pembentukan ikatan lainnya. Energi akibat reaksi tidak muncul begitu saja dan tidak musnah: energi itulah yang diperlukan untuk memutus atau membentuk ikatan-ikatan tersebut. Oleh karena itu, perubahan entalpi seluruh reaksi dapat diperkirakan secara akurat dengan menjumlahkan energi ikatan-ikatan ini.
Gunakan entalpi pembentukan untuk memperkirakan entalpi. Entalpi pembentukan memungkinkan seseorang menghitung ∆H dengan menghitung reaksi pembentukan reaktan dan produk. Jika entalpi pembentukan produk reaksi dan reaktan diketahui, entalpi secara keseluruhan dapat diperkirakan dengan penjumlahan, seperti dalam kasus energi yang dibahas di atas.
-
Jangan lupakan tanda di depan nilai entalpi. Saat menghitung entalpi pembentukan, Anda membalikkan rumus untuk menentukan entalpi reaksi produk, dan tanda entalpinya akan berubah. Dengan kata lain, jika rumusnya dibalik, tanda entalpinya akan berubah menjadi kebalikannya.
- Dalam contoh tersebut, perhatikan bahwa reaksi pembentukan produk C 2 H 5 OH ditulis terbalik. C 2 H 5 OH → 2C + 3H 2 + 0,5O 2 yaitu C 2 H 5 OH terurai dan tidak disintesis. Oleh karena itu, tanda entalpi reaksi tersebut adalah positif, 228 kJ/mol, meskipun entalpi pembentukan C 2 H 5 OH adalah -228 kJ/mol.
Pengamatan entalpi selama percobaan
-
Ambil wadah bersih dan tuangkan air ke dalamnya. Tidak sulit untuk melihat prinsip-prinsip entalpi dalam tindakan - cukup lakukan percobaan sederhana. Penting agar hasil percobaan tidak terpengaruh oleh kontaminan asing, sehingga wadah harus dicuci dan disterilkan. Para ilmuwan menggunakan wadah tertutup khusus yang disebut kalorimeter untuk mengukur entalpi, tetapi gelas kimia atau labu juga bisa digunakan. Isi wadah dengan bersih keran air suhu kamar. Dianjurkan untuk melakukan percobaan di ruangan yang sejuk.
- Untuk percobaan disarankan menggunakan wadah kecil. Kita akan melihat entalpi reaksi air dengan Alka-Seltzer, jadi semakin sedikit air yang digunakan, semakin jelas perubahan suhunya.
Identifikasi reaktan dan produk reaksi. Setiap reaksi kimia mempunyai reaktan dan produk reaksi. Produk reaksi dibuat sebagai hasil interaksi reagen. Dengan kata lain, reaktan adalah bahan-bahan dalam resep, dan produk reaksinya adalah hidangan jadi. Untuk mencari ∆H suatu reaksi, Anda perlu mengetahui reaktan dan produk reaksi.
Tekanan atmosfer biasanya berperan sebagai tekanan konstan. Entalpi, seperti energi dalam, adalah fungsi keadaan. Energi dalam adalah jumlah energi kinetik dan energi potensial seluruh sistem. Ini adalah dasar persamaan entalpi. Entalpi adalah jumlah dikalikan volume sistem dan sama dengan: H = U + pV, dimana p adalah tekanan dalam sistem, V adalah volume sistem ketiga besaran diberikan: tekanan, volume dan energi dalam. Namun entalpi tidak selalu dihitung dengan cara ini. Selain itu, ada beberapa cara lain untuk menghitung entalpi.
Mengetahui energi bebas dan entropi, kita dapat menghitungnya entalpi. Energi bebas, atau energi Gibbs, adalah bagian entalpi sistem yang diubah menjadi kerja, dan sama dengan selisih antara entalpi dan suhu dikalikan entropi: ΔG = ΔH-TΔS (ΔH, ΔG, ΔS - kenaikan nilai) Entropi dalam rumus ini adalah ukuran ketidakteraturan sistem partikel. Ini meningkat dengan meningkatnya suhu T dan tekanan. Di ΔG<0 процесс идет самопроизвольно, при ΔG>0 - tidak berfungsi.
Selain itu, entalpi juga dihitung dari persamaan kimia. Jika persamaan reaksi kimia berbentuk A+B=C diberikan, maka entalpi dapat ditentukan dengan rumus: dH = dU + ΔnRT, dimana Δn = nk-nн (nk dan nн adalah jumlah mol produk reaksi dan zat awal) Dalam proses isobarik, entropi sama dengan perubahan panas dalam sistem: dq = dH. Pada tekanan konstan, entalpi sama dengan: H=∫CpdTDalam kasus di mana entalpi dan entropi seimbang, kenaikan entalpi sama dengan produk kenaikan suhu dan entropi: ΔH=TΔS
Sumber:
- cara menghitung perubahan entropi suatu reaksi
Ke kuantitas panas diterima atau diberikan suatu zat, perlu dicari massanya, serta perubahan suhunya. Dengan menggunakan tabel kapasitas panas spesifik, temukan nilai ini dari bahan ini, lalu hitung jumlah kalor menggunakan rumus. Anda dapat menentukan jumlah panas yang dilepaskan selama pembakaran bahan bakar dengan mengetahui massa dan panas spesifik pembakaran. Situasinya sama dengan peleburan dan penguapan.
Anda akan membutuhkan
- Untuk menentukan besarnya kalor, ambil kalorimeter, termometer, timbangan, tabel sifat termal suatu zat.
instruksi
Perhitungan jumlah yang diberikan atau diterima oleh tubuh. Ukur berat badan pada skala dalam kilogram, kemudian ukur suhu dan panaskan, batasi kontak sebanyak mungkin lingkungan eksternal, ukur suhunya lagi. Untuk melakukan ini, gunakan bejana berinsulasi termal (kalorimeter). Dalam praktiknya, hal ini dapat dilakukan dengan cara ini: ambil benda apa pun pada suhu kamar, ini akan menjadi miliknya nilai awal. Lalu tuang ke dalam kalorimeter air panas dan membenamkan tubuh di sana. Setelah beberapa saat (tidak langsung, badan harus melakukan pemanasan), ukur suhu airnya, nanti sama dengan suhu tubuh. Dalam tabel kapasitas panas spesifik, temukan nilai ini untuk bahan dari mana benda yang diteliti dibuat. Maka banyaknya kalor akan menjadi hasil kali kapasitas kalor jenis dan massa benda serta suhunya (Q=c m (t2-t1)). Hasilnya akan diperoleh dalam joule. Suhu dapat dinyatakan dalam derajat Celcius. Jika jumlah panasnya positif, maka tubuh memanas, jika dingin.
Perhitungan jumlah panas selama pembakaran bahan bakar. Ukur massa bahan bakar yang terbakar. Jika berbentuk cair, ukur volumenya dan kalikan dengan massa jenis yang diambil dalam tabel khusus. Kemudian, pada tabel referensi, carilah kalor jenis pembakaran bahan bakar tersebut dan kalikan dengan massanya. Hasilnya adalah jumlah panas yang dilepaskan selama pembakaran bahan bakar.
Perhitungan jumlah panas selama peleburan dan penguapan. Ukur massa benda leleh, dan kapasitas panas spesifik suhu leleh suatu zat tertentu dari tabel khusus. Kalikan nilai-nilai ini dan dapatkan jumlah yang diserap tubuh selama pencairan. Jumlah panas yang sama dilepaskan oleh tubuh selama kristalisasi.
Untuk mengukur jumlah kalor yang diserap suatu zat cair, carilah massanya, serta kalor jenis penguapannya. Produk dari besaran-besaran ini akan memberikan jumlah panas yang diserap oleh cairan tertentu selama penguapan. Selama kondensasi, jumlah panas yang dilepaskan akan sama persis dengan yang diserap selama penguapan.
Video tentang topik tersebut
Panas memengaruhi Suatu sistem termodinamika muncul karena terjadinya reaksi kimia di dalamnya, namun bukan merupakan salah satu cirinya. Nilai ini hanya dapat ditentukan jika kondisi tertentu terpenuhi.

instruksi
Konsep termal a erat kaitannya dengan konsep entalpi sistem termodinamika. Ini energi panas, yang dapat diubah menjadi panas ketika suhu dan tekanan tertentu tercapai. Nilai ini mencirikan keadaan keseimbangan sistem.
Saat bekerja dengan segala perhitungan, penghitungan, dan prakiraan berbagai fenomena yang berkaitan dengan teknik termal, setiap orang dihadapkan pada konsep entalpi. Namun bagi orang-orang yang spesialisasinya tidak berhubungan dengan teknik tenaga termal atau yang hanya mengenal istilah-istilah tersebut secara dangkal, kata “entalpi” akan menimbulkan ketakutan dan kengerian. Jadi, mari kita cari tahu apakah semuanya benar-benar menakutkan dan tidak bisa dipahami?
Sederhananya, istilah entalpi mengacu pada energi yang tersedia untuk diubah menjadi panas pada tekanan konstan. Konsep entalpi yang diterjemahkan dari bahasa Yunani berarti “panas.” Artinya, rumus yang mengandung jumlah dasar energi dalam dan usaha yang dilakukan disebut entalpi. Nilai ini dilambangkan dengan huruf i.
Jika kita menuliskan hal di atas besaran fisis, ubah dan turunkan rumusnya, Anda mendapatkan i = u + pv (di mana u adalah energi dalam; p, u adalah tekanan dan volume spesifik fluida kerja dalam keadaan yang sama dengan nilai energi dalam yang diambil). Entalpi merupakan fungsi aditif, yaitu entalpi seluruh sistem sama dengan jumlah seluruh bagian penyusunnya.

Istilah "entalpi" rumit dan memiliki banyak segi.
Tetapi jika Anda mencoba memahaminya, semuanya akan berjalan sangat sederhana dan jelas.
- Pertama, untuk memahami apa itu entalpi, perlu diketahui definisi umum, itulah yang kami lakukan.
- Kedua, ada baiknya menemukan mekanisme kemunculan unit fisik ini, memahami dari mana asalnya.
- Ketiga, Anda perlu terhubung dengan orang lain. unit fisik, yang saling berhubungan erat dengannya.
- Dan yang terakhir, keempat, Anda perlu melihat contoh dan rumusnya.
Nah, mekanisme pengoperasiannya jelas. Anda hanya perlu membaca dan memahaminya dengan seksama. Kita telah membahas istilah “Entalpi”, dan kami juga telah memberikan rumusnya. Namun pertanyaan lain segera muncul: dari mana rumus ini berasal dan mengapa entropi terkait, misalnya, dengan energi dan tekanan internal?
Esensi dan makna
Untuk mencoba mencari tahu arti fisik konsep “entalpi” Anda perlu mengetahui hukum pertama termodinamika:
energi tidak hilang begitu saja dan tidak timbul dari ketiadaan, melainkan hanya berpindah dari satu jenis ke jenis lainnya dalam jumlah yang sama. Contohnya adalah perpindahan panas (energi panas) ke dalam energi mekanik, dan sebaliknya.
Kita perlu mengubah persamaan hukum pertama termodinamika ke dalam bentuk dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Dari sini kita melihat ekspresi (u + pv). Ekspresi inilah yang disebut entalpi ( rumus lengkap diberikan di atas).
Entalpi juga merupakan besaran keadaan, karena komponen u (tegangan) dan p (tekanan), v (volume spesifik) mempunyai masing-masing besaran. nilai-nilai tertentu. Mengetahui hal ini, hukum pertama termodinamika dapat ditulis ulang menjadi: dq = di – vdp.
Dalam termodinamika teknis, nilai entalpi digunakan, yang dihitung dari nol yang diterima secara konvensional. Semua nilai absolut Besaran-besaran ini sangat sulit ditentukan, karena untuk itu perlu memperhitungkan semua komponen energi dalam suatu zat ketika wujudnya berubah dari O ke K.
Rumus dan nilai entalpi diberikan pada tahun 1909 oleh ilmuwan G. Kamerlingh Onnes.
Dalam ungkapan, i adalah entalpi spesifik; untuk seluruh massa benda, entalpi total dilambangkan dengan huruf I; menurut sistem satuan universal, entalpi diukur dalam Joule per kilogram dan dihitung sebagai:
Fungsi
Entalpi (“E”) adalah salah satu fungsi tambahan yang dapat menyederhanakan perhitungan termodinamika secara signifikan. Misalnya, sejumlah besar proses pasokan panas dalam rekayasa tenaga panas (di ketel uap atau ruang bakar turbin gas dan mesin jet, serta di penukar panas) dilakukan pada tekanan konstan. Oleh karena itu, nilai entalpi biasanya diberikan dalam tabel sifat termodinamika.
Kondisi kekekalan entalpi, khususnya, terletak pada dasar teori Joule-Thomson. Atau efek menemukan sesuatu yang penting aplikasi praktis saat mencairkan gas. Jadi, entalpi adalah energi total sistem yang diperluas, mewakili jumlah energi internal dan energi eksternal. energi potensial tekanan. Seperti parameter keadaan lainnya, entalpi dapat ditentukan oleh pasangan parameter keadaan independen mana pun.
Selain itu, berdasarkan rumus di atas, kita dapat mengatakan: “E” suatu reaksi kimia sama dengan jumlah entalpi pembakaran zat awal dikurangi jumlah entalpi pembakaran produk reaksi.
Secara umum, perubahan energi pada sistem termodinamika tidak terjadi suatu kondisi yang diperlukan untuk mengubah entropi sistem ini.
Entalpi adalah sifat suatu zat yang menunjukkan jumlah energi yang dapat diubah menjadi panas.Jadi, di sini kita telah melihat konsep “entalpi”. Perlu dicatat bahwa "E" terkait erat dengan entropi, yang juga dapat Anda baca nanti.
Entalpi adalah sifat termodinamika suatu zat yang menunjukkan tingkat energi, diawetkan dalam struktur molekulnya. Artinya, meskipun suatu zat mempunyai energi berdasarkan , tidak semuanya dapat diubah menjadi panas. Bagian dari energi internal selalu tertinggal dalam substansi dan mempertahankan struktur molekulnya. Beberapa zat tidak dapat diakses ketika suhunya mendekati suhu lingkungan. Karena itu, entalpi adalah jumlah energi yang tersedia untuk diubah menjadi panas pada suhu dan tekanan tertentu. Satuan entalpi- Satuan termal British atau joule untuk energi dan Btu/lbm atau J/kg untuk energi spesifik.
Kuantitas entalpi
Kuantitas entalpi materi berdasarkan suhu tertentu. Suhu ini- inilah nilai yang dipilih oleh para ilmuwan dan insinyur sebagai dasar perhitungan. Ini adalah suhu di mana entalpi suatu zat adalah nol J. Dengan kata lain, zat tersebut tidak memiliki energi yang dapat diubah menjadi panas. Suhu ini berbeda untuk zat yang berbeda. Misalnya, suhu air ini adalah titik tripel (0 °C), nitrogen -150 °C, dan zat pendingin berbahan dasar metana dan etana adalah -40 °C.Jika suhu suatu zat lebih tinggi dari suhu tertentu atau berubah wujud menjadi gas pada suhu tertentu, entalpi dinyatakan sebagai bilangan positif. Sebaliknya, pada suhu di bawah suhu tersebut, entalpi suatu zat dinyatakan sebagai bilangan negatif. Entalpi digunakan dalam perhitungan untuk menentukan perbedaan tingkat energi antara dua keadaan. Hal ini diperlukan untuk menyiapkan peralatan dan menentukan efek menguntungkan dari proses tersebut.
Entalpi sering didefinisikan sebagai energi total materi, karena sama dengan jumlah energi dalam (u) pada keadaan tertentu beserta kemampuannya untuk melakukan usaha (pv). Namun kenyataannya, entalpi tidak menunjukkan energi total suatu zat pada suhu tertentu di atas nol mutlak(-273°C). Oleh karena itu, alih-alih mendefinisikan entalpi sebagai kalor total suatu zat, maka lebih akurat didefinisikan sebagai jumlah total energi yang tersedia suatu zat yang dapat diubah menjadi panas.
H = U + pV