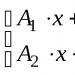Ini adalah zat yang berdisosiasi dalam larutan untuk membentuk ion hidrogen.
Asam diklasifikasikan berdasarkan kekuatannya, berdasarkan kebasaannya, dan berdasarkan ada tidaknya oksigen dalam asam.
Dengan kekuatanasam dibagi menjadi kuat dan lemah. Asam kuat yang paling penting adalah nitrat HNO 3, H2SO4 sulfat, dan HCl klorida.
Menurut keberadaan oksigen membedakan asam yang mengandung oksigen ( HNO3, H3PO4 dll.) dan asam bebas oksigen ( HCl, H 2 S, HCN, dll).
Secara mendasar, yaitu. Menurut jumlah atom hidrogen dalam molekul asam yang dapat digantikan oleh atom logam untuk membentuk garam, asam dibagi menjadi monobasa (misalnya, HNO 3, HCl), dibasic (H 2 S, H 2 SO 4), tribasic (H 3 PO 4), dan seterusnya.
Nama asam bebas oksigen diambil dari nama nonlogam dengan tambahan akhiran -hidrogen: HCl - asam klorida, H2S e - asam hidroselenat, HCN - asam hidrosianat.
Nama-nama asam yang mengandung oksigen juga dibentuk dari nama Rusia dari unsur yang bersangkutan dengan penambahan kata “asam”. Dalam hal ini, nama asam yang unsurnya berada pada bilangan oksidasi tertinggi diakhiri dengan “naya” atau “ova”, misalnya, H2SO4 - asam sulfat, HClO4 - asam perklorat, H3AsO4 - asam arsenik. Dengan penurunan bilangan oksidasi unsur pembentuk asam, ujung-ujungnya berubah dalam urutan berikut: “bulat telur” ( HClO3 - asam perklorat), “padat” ( HClO2 - asam klor), “bulat telur” ( H HAI Kl - asam hipoklorit). Jika suatu unsur membentuk asam hanya dalam dua bilangan oksidasi, maka nama asamnya sesuai dengan derajat terendah oksidasi suatu unsur, menerima akhiran “terhapus” ( HNO3 - asam nitrat, HNO2 - asam nitrat).
Tabel - Asam terpenting dan garamnya
|
Asam |
Nama-nama garam normal yang bersesuaian |
|
|
Nama |
Rumus |
|
|
Nitrogen |
HNO3 |
Nitrat |
|
Nitrogen |
HNO2 |
Nitrit |
|
Borik (ortoborik) |
H3BO3 |
Borat (ortoborat) |
|
Hidrobromik |
bromida |
|
|
Hidroiodida |
iodida |
|
|
Silikon |
H2SiO3 |
Silikat |
|
mangan |
HMnO4 |
Permanganat |
|
Metafosfat |
HPO3 |
Metafosfat |
|
Arsenik |
H3AsO4 |
Arsenat |
|
Arsenik |
H3AsO3 |
Arsenit |
|
Ortofosfat |
H3PO4 |
Ortofosfat (fosfat) |
|
Difosfor (pirofosfor) |
H4P2O7 |
Difosfat (pirofosfat) |
|
Dikrom |
H2Cr2O7 |
Dikromat |
|
belerang |
H2SO4 |
sulfat |
|
Berapi |
H2SO3 |
Sulfit |
|
Batu bara |
H2CO3 |
Karbonat |
|
Fosfor |
H3PO3 |
Fosfit |
|
Hidrofluorik (fluorik) |
Fluorida |
|
|
Hidroklorik (garam) |
Klorida |
|
|
Klorin |
HClO4 |
Perklorat |
|
Klorin |
HClO3 |
Klorat |
|
hipoklorit |
HClO |
Hipoklorit |
|
krom |
H2CrO4 |
Kromat |
|
Hidrogen sianida (sianat) |
Sianida |
|
Memperoleh asam
1. Asam anoksik dapat diperoleh dengan menggabungkan langsung nonlogam dengan hidrogen:
H 2 + Cl 2 → 2HCl,
H 2 + S H 2 S.
2. Asam yang mengandung oksigen seringkali dapat diperoleh dengan menggabungkan langsung oksida asam dengan air:
JADI 3 + H 2 O = H 2 JADI 4,
CO 2 + H 2 O = H 2 CO 3,
P 2 O 5 + H 2 O = 2 HPO 3.
3. Asam bebas oksigen dan asam yang mengandung oksigen dapat diperoleh melalui reaksi pertukaran antara garam dan asam lainnya:
BaBr 2 + H 2 SO 4 = BaSO 4 + 2HBr,
CuSO 4 + H 2 S = H 2 SO 4 + CuS,
CaCO 3 + 2HBr = CaBr 2 + CO 2 + H 2 O.
4. Dalam beberapa kasus, reaksi redoks dapat digunakan untuk menghasilkan asam:
H 2 O 2 + JADI 2 = H 2 JADI 4,
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
Sifat kimia asam
1. Sifat kimia asam yang paling khas adalah kemampuannya untuk bereaksi dengan basa (serta basa dan oksida amfoter) dengan terbentuknya garam, misalnya:
H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O,
2HNO 3 + FeO = Fe(NO 3) 2 + H 2 O,
2 HCl + ZnO = ZnCl 2 + H 2 O.
2. Kemampuan berinteraksi dengan beberapa logam pada rangkaian tegangan hingga hidrogen, dengan pelepasan hidrogen:
Zn + 2HCl = ZnCl 2 + H 2,
2Al + 6HCl = 2AlCl3 + 3H2.
3. Dengan garam, jika terbentuk garam yang sedikit larut atau zat yang mudah menguap:
H 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2HCl,
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2,
2KHCO 3 + H 2 JADI 4 = K 2 JADI 4 +2JADI 2+ 2H 2 O.
Perhatikan bahwa asam polibasa berdisosiasi secara bertahap, dan kemudahan disosiasi pada setiap tahap menurun oleh karena itu, untuk asam polibasa, garam asam sering kali terbentuk sebagai pengganti garam sedang (jika asam yang bereaksi berlebih):
Na 2 S + H 3 PO 4 = Na 2 HPO 4 + H 2 S,
NaOH + H 3 PO 4 = NaH 2 PO 4 + H 2 O.
4. Kasus khusus interaksi asam-basa adalah reaksi asam dengan indikator, yang menyebabkan perubahan warna, yang telah lama digunakan untuk deteksi kualitatif asam dalam larutan. Jadi, lakmus berubah warna dalam suasana asam menjadi merah.
5. Ketika dipanaskan, asam yang mengandung oksigen terurai menjadi oksida dan air (sebaiknya dengan adanya bahan penghilang air P2O5):
H 2 JADI 4 = H 2 O + JADI 3,
H 2 SiO 3 = H 2 O + SiO 2.
M.V. Andryukhova, L.N. Borodina
Asam dipanggil zat kompleks, molekulnya meliputi atom hidrogen yang dapat diganti atau ditukar dengan atom logam dan residu asam.
Berdasarkan ada tidaknya oksigen dalam molekulnya, asam dibedakan menjadi asam yang mengandung oksigen(H 2 SO 4 asam sulfat, H 2 SO 3 asam sulfat, asam nitrat HNO 3, asam fosfat H 3 PO 4, H 2 CO 3 asam karbonat, H 2 SiO 3 asam silikat) dan bebas oksigen(Asam fluorida HF, asam klorida HCl (asam klorida), asam hidrobromat HBr, asam hidroiodik HI, asam hidrosulfida H 2 S).
Tergantung pada jumlah atom hidrogen dalam molekul asam, asam bersifat monobasa (dengan 1 atom H), dibasa (dengan 2 atom H) dan tribasa (dengan 3 atom H). Misalnya asam nitrat HNO 3 bersifat monobasa, karena molekulnya mengandung satu atom hidrogen, asam sulfat H 2 SO 4 – dibasic, dll.
Sangat sedikit senyawa anorganik yang mengandung empat atom hidrogen yang dapat digantikan oleh logam.
Bagian molekul asam tanpa hidrogen disebut residu asam.
Residu asam dapat terdiri dari satu atom (-Cl, -Br, -I) - ini adalah residu asam sederhana, atau dapat terdiri dari sekelompok atom (-SO 3, -PO 4, -SiO 3) - ini adalah residu kompleks.
DI DALAM larutan berair Selama reaksi pertukaran dan substitusi, residu asam tidak hancur:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
Kata anhidrida berarti anhidrat, yaitu asam tanpa air. Misalnya,
H 2 JADI 4 – H 2 O → JADI 3. Asam anoksik tidak memiliki anhidrida.
Asam mendapatkan namanya dari nama unsur pembentuk asam (zat pembentuk asam) dengan penambahan akhiran “naya” dan lebih jarang “vaya”: H 2 SO 4 – sulfat; H 2 SO 3 – batubara; H 2 SiO 3 – silikon, dll.
Unsur tersebut dapat membentuk beberapa asam oksigen. Dalam hal ini, akhiran yang ditunjukkan pada nama asam adalah ketika unsur tersebut menunjukkan valensi yang lebih tinggi (molekul asam mengandung atom oksigen yang tinggi). Jika suatu unsur menunjukkan valensi yang lebih rendah, akhiran nama asamnya akan “kosong”: HNO 3 - nitrat, HNO 2 - nitrogen.
Asam dapat diperoleh dengan melarutkan anhidrida dalam air. Jika anhidrida tidak larut dalam air, asam dapat diperoleh dengan aksi asam kuat lainnya pada garam dari asam yang diperlukan. Metode ini khas untuk oksigen dan asam bebas oksigen. Asam bebas oksigen juga diperoleh dengan sintesis langsung dari hidrogen dan non-logam, diikuti dengan melarutkan senyawa yang dihasilkan dalam air:
H 2 + Cl 2 → 2 HCl;
H 2 + S → H 2 S.
Solusi yang didapat zat berbentuk gas HCl dan H 2 S adalah asam.
Dalam kondisi normal, asam ada dalam bentuk cair dan padat.
Sifat kimia asam
Larutan asam bekerja pada indikator. Semua asam (kecuali silikat) sangat larut dalam air. Zat khusus - indikator memungkinkan Anda menentukan keberadaan asam.
Indikator adalah zat struktur yang kompleks. Mereka mengubah warnanya tergantung pada interaksi mereka dengan orang lain bahan kimia. Dalam larutan netral mereka mempunyai satu warna, dalam larutan basa mereka mempunyai warna lain. Ketika berinteraksi dengan asam, mereka berubah warna: indikator metil jingga berubah menjadi merah, dan indikator lakmus juga berubah menjadi merah.
Berinteraksi dengan pangkalan dengan pembentukan air dan garam, yang mengandung residu asam yang tidak berubah (reaksi netralisasi):
H 2 SO 4 + Ca(OH) 2 → CaSO 4 + 2 H 2 O.
Berinteraksi dengan oksida basa dengan terbentuknya air dan garam (reaksi netralisasi). Garam mengandung residu asam dari asam yang digunakan dalam reaksi netralisasi:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
 Berinteraksi dengan logam.
Agar asam dapat berinteraksi dengan logam, kondisi tertentu harus dipenuhi:
Berinteraksi dengan logam.
Agar asam dapat berinteraksi dengan logam, kondisi tertentu harus dipenuhi:
1. logam harus cukup aktif terhadap asam (dalam rangkaian aktivitas logam harus ditempatkan sebelum hidrogen). Semakin jauh ke kiri suatu logam dalam rangkaian aktivitasnya, semakin kuat interaksinya dengan asam;
2. asam harus cukup kuat (yaitu mampu mendonorkan ion hidrogen H+).
Saat bocor reaksi kimia asam dengan logam, garam terbentuk dan hidrogen dilepaskan (kecuali interaksi logam dengan asam nitrat dan asam sulfat pekat):
Zn + 2HCl → ZnCl 2 + H 2 ;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Masih ada pertanyaan? Ingin tahu lebih banyak tentang asam?
Untuk mendapatkan bantuan dari tutor, daftarlah.
Pelajaran pertama gratis!
situs web, ketika menyalin materi secara keseluruhan atau sebagian, diperlukan tautan ke sumbernya.
) dan residu asam.
Ada beberapa definisi asam dan basa, tergantung teorinya:
Klasifikasi asam.
2KHSO 3 + H 2 SO 4 = K 2 SO 4 + 2SO 2 + 2H 2 O,
2 CO3 + 4HBr = 2CuBr 2 + CO 2 + 3H 2 O.
4. Dalam kasus asam polibasa, mereka berdisosiasi secara bertahap, sehingga pembentukannya sering diamati garam asam bukannya rata-rata:
KOH + H 2 S = KHS + H 2 O.
5. Reaksi dengan indikator: Lakmus dalam suasana asam berubah menjadi merah, jingga metil menjadi merah, Kongo menjadi merah menjadi biru.
6. Sifat khusus asam:
|
Pendidikan garam yang tidak larut: |
|
|
AgNO 3 + HCl = AgCl↓ (endapan putih) + HNO 3. |
2KMnO 4 + 16HCl = 5Cl 2 + 2KCl + 2MnCl 2 +8H 2 O. |
|
3AgNO 3 + H 3 PO 4 = Ag 3 PO 4 ↓ (endapan kuning) + 3HNO 3. |
H 2 S + Br 2 = S + 2HBr. |
|
Jika asam yang mengandung oksigen bereaksi, ia hanya dapat teroksidasi jika berada dalam keadaan oksidasi antara: |
|
|
H 2 SO 3 + Cl 2 + H 2 O = H 2 SO 4 + 2HCl. |
|
|
Dalam kasus lain, mereka adalah agen pengoksidasi. Properti ini terutama terlihat ketika berinteraksi dengan zat sederhana: |
|
|
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O. |
Asam itu kompleks senyawa kimia, yang mengandung satu atau lebih atom hidrogen dan residu asam. Kata “asam” mempunyai arti yang berkaitan dengan kata “asam”, karena memang ada akar yang sama. Oleh karena itu, larutan semua asam mempunyai rasa asam. Meskipun demikian, tidak semua larutan asam dapat dicicipi, karena beberapa di antaranya bersifat kaustik dan beracun. Asam, karena sifatnya, banyak digunakan dalam kehidupan sehari-hari, kedokteran, industri dan bidang lainnya.
Sejarah studi tentang asam
Asam telah dikenal umat manusia sejak zaman kuno. Jelasnya, asam pertama yang diperoleh manusia sebagai hasil fermentasi (oksidasi di udara) adalah anggur asam asetat. Itupun telah diketahui beberapa sifat asam yang digunakan untuk melarutkan logam dan memperoleh pigmen mineral, misalnya: timbal karbonat. Selama Abad Pertengahan, para alkemis “menemukan” asam baru yang berasal dari mineral. Upaya pertama untuk menyatukan semua asam dengan sifat yang sama dilakukan oleh ahli kimia fisik Svante Arrhenius (Stockholm, 1887). Saat ini, sains menganut teori asam dan basa Brønsted-Lowry dan Lewis, yang didirikan pada tahun 1923.
Asam oksalat (asam etanadioat) bersifat kuat asam organik dan memiliki semua properti asam karboksilat. Ini adalah kristal tidak berwarna yang larut dengan baik dalam air, tetapi tidak sepenuhnya larut dalam air etil alkohol dan tidak larut dalam benzena. Di alam, asam oksalat ditemukan pada tumbuhan seperti coklat kemerah-merahan, karom, rhubarb, dll.
Aplikasi:
DI DALAM industri kimia(untuk produksi tinta, plastik);
Dalam metalurgi (untuk membersihkan karat, kerak);
Di industri tekstil (untuk mewarnai bulu dan kain);
Dalam tata rias (zat pemutih);
Untuk memurnikan dan mengurangi kesadahan air;
Dalam pengobatan;
Dalam farmakologi.
 Asam oksalat bersifat racun dan toksik; jika terkena kulit, selaput lendir dan organ pernafasan dapat menyebabkan iritasi.
Asam oksalat bersifat racun dan toksik; jika terkena kulit, selaput lendir dan organ pernafasan dapat menyebabkan iritasi.
Di toko online kami, Anda dapat membeli asam oksalat hanya dengan 258 rubel.
Asam salisilat adalah bubuk kristal yang larut dengan baik dalam alkohol tetapi buruk dalam air. Ini pertama kali diperoleh dari kulit pohon willow (dari mana ia mendapatkan namanya) oleh ahli kimia Raphael Piria pada tahun 1838 di Italia.
Banyak digunakan:
Dalam farmakologi;
Dalam pengobatan (anti inflamasi, penyembuhan luka, antiseptik untuk pengobatan luka bakar, kutil, jerawat, eksim, rambut rontok, keringat berlebih, iktiosis, kapalan, pitiriasis versikolor, dll);
Dalam tata rias (sebagai exfoliant, antiseptik);
DI DALAM industri makanan(saat mengalengkan makanan).
Jika terjadi overdosis asam ini membunuh bakteri menguntungkan, mengeringkan kulit, yang dapat menyebabkan jerawat. Tidak disarankan menggunakannya sebagai produk kosmetik lebih dari sekali sehari.
Harga asam salisilat hanya 308 rubel.
Asam borat (asam ortoborat) berbentuk bubuk kristal mengkilat, berminyak jika disentuh. Mengacu pada asam lemah, larut lebih baik air panas dan dalam larutan garam, lebih sedikit dalam larutan garam air dingin dan asam mineral. Terjadi di alam dalam bentuk mineral sassolin, in perairan mineral, air asin alami dan sumber air panas.
Berlaku:
Dalam industri (dalam produksi enamel, semen, deterjen);
Dalam tata rias;
DI DALAM pertanian(sebagai pupuk);
Di laboratorium;
Dalam farmakologi dan kedokteran (antiseptik);
Dalam kehidupan sehari-hari (untuk memerangi serangga);
Dalam memasak (untuk pengalengan dan sebagai bahan tambahan makanan).
Beli asam borat di Moskow hanya dengan 114 rubel.
Asam sitrat merupakan bahan tambahan pangan (E330/E333) yang berbentuk putih zat kristal. Ini larut dengan baik dalam air dan etil alkohol. Di alam, banyak ditemukan di buah jeruk, beri, jarum pinus, dll. Asam sitrat pertama kali diperoleh dari jus lemon mentah oleh apoteker Karl Scheele (Swedia, 1784).
Asam sitrat telah menemukan penerapannya:
Dalam industri makanan (sebagai bahan penyedap rasa, saus, produk setengah jadi);
Di industri minyak dan gas (saat pengeboran sumur);
Dalam tata rias (dalam krim, sampo, lotion, produk mandi);
Dalam farmakologi;
Dalam kehidupan sehari-hari (dalam pembuatan deterjen).
Namun, saat dipukul larutan terkonsentrasi asam sitrat pada kulit, selaput lendir mata atau email gigi mungkin berbahaya.
Beli asam sitrat di situs web kami mulai 138 rubel.
 Asam laktat merupakan cairan bening dengan sedikit bau yang tergolong bahan tambahan pangan (E270). Untuk pertama kalinya, asam laktat, serta asam sitrat, diperoleh oleh ahli kimia Karl Scheele. Saat ini diperoleh dengan memfermentasi susu, anggur atau bir.
Asam laktat merupakan cairan bening dengan sedikit bau yang tergolong bahan tambahan pangan (E270). Untuk pertama kalinya, asam laktat, serta asam sitrat, diperoleh oleh ahli kimia Karl Scheele. Saat ini diperoleh dengan memfermentasi susu, anggur atau bir.
Aplikasi:
Dalam industri (untuk pembuatan keju, mayones, yogurt, kefir, kembang gula);
Di bidang pertanian (untuk menyiapkan pakan);
Dalam kedokteran hewan (antiseptik);
Dalam tata rias (zat pemutih).
Saat menangani asam laktat, Anda harus berhati-hati, karena dapat menyebabkan kulit kering, nekrosis selaput lendir mata, dll.
Beli asam laktat sekarang seharga 129 rubel.
Toko reagen kimia ritel Prime Chemicals Group di Moskow adalah pilihan peralatan laboratorium dan reagen kimia yang sangat baik dengan harga terjangkau.
Ada dua jenis asam: organik dan anorganik; perbedaan di antara keduanya adalah asam organik selalu mengandung molekul karbon.
Yang organik masuk ke dalam tubuh dengan buah beri, sayuran, buah-buahan dan produk susu. Beberapa asam adalah vitamin, misalnya vitamin C - asam askorbat.
Asam anorganik dapat juga diperoleh melalui makanan, namun dapat juga diproduksi oleh tubuh secara mandiri. Asam klorida hadir di jus lambung, di bawah aksinya bakteri yang masuk ke perut dengan makanan mati. Asam hidrogen sulfida ditemukan dalam air mineral.
Penerapan asam
Asam sulfat menempati urutan pertama di antara asam. Dia ada di dalam dalam jumlah besar digunakan untuk produksi pupuk, serat kimia, dan obat-obatan. Ini digunakan untuk mengisi baterai asam dan digunakan untuk mengekstraksi logam dari bijih. Dalam industri minyak digunakan untuk memurnikan produk minyak bumi.
Asam asetat memiliki efek bakterisida, larutannya digunakan dalam pengawetan makanan, untuk produksi obat-obatan, dalam produksi, dalam pewarnaan dan pencetakan.
Asam klorida digunakan untuk merawat zona sumur di industri minyak.
Peran asam nitrat peran besar dalam produksi pupuk, pernis, pewarna, plastik, bahan peledak dan bahan obat.
Asam fosfat termasuk dalam komposisi pembersih lemak untuk bahan logam sebelum menerapkan senyawa pelindung padanya. Ini termasuk dalam komposisi zat untuk mengubah karat sebelum mengaplikasikan cat, dan digunakan sebagai perlindungan terhadap korosi pada pipa.
Asam sitrat digunakan dalam pembuatan kosmetik, sebagai pengencer dan pengawet. Karena sifatnya yang memutihkan, membersihkan, dan astringen, ia termasuk dalam krim pembersih, obat kumur, krim pigmentasi, dan pewarna rambut.
Asam asetilsalisilat efektif dalam pencegahan penyakit pada sistem kardiovaskular, mengurangi pembentukan bekuan darah, dan memiliki efek analgesik, oleh karena itu digunakan.
Asam borat juga digunakan karena sifat antiseptiknya. Ini digunakan untuk pedikulosis (kutu), dalam pengobatan otitis media, konjungtivitis, dan radang kulit.
Asam stearat digunakan dalam pembuatan sabun. Menambahkannya ke sabun memastikan produk membuat kulit halus, lembut dan memiliki efek menenangkan.