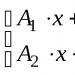Asam nitrat dan khasiatnya.
Asam nitrat murni HNO 3 adalah cairan tidak berwarna. Di udara, ia “berasap”, seperti asam klorida pekat, karena uapnya membentuk tetesan kecil kabut dengan uap air di udara.
Asam nitrat tidak kuat. Sudah di bawah pengaruh cahaya, secara bertahap terurai:
4HN0 3 = 4N0 2 + 0 2 + 2H 2 0.
Semakin tinggi suhu dan semakin pekat asamnya, semakin cepat terjadinya dekomposisi. Nitrogen dioksida yang dilepaskan larut dalam asam dan memberinya warna coklat.
Asam nitrat adalah salah satu asam terkuat: dalam larutan encer asam nitrat terurai sempurna menjadi ion H+ dan N0 _.
Asam nitrat adalah salah satu zat pengoksidasi yang paling energik. Banyak non-logam mudah teroksidasi olehnya, berubah menjadi asam yang sesuai. Jadi, belerang, ketika direbus dengan asam nitrat, secara bertahap dioksidasi menjadi asam sulfat, fosfor menjadi asam fosfat.
Asam nitrat bekerja pada hampir semua logam (lihat bagian 11.3.2), mengubahnya menjadi nitrat, dan beberapa logam menjadi oksida.
HNO 3 pekat memasivasi beberapa logam.
Bilangan oksidasi nitrogen dalam asam nitrat adalah +5. Bertindak sebagai zat pengoksidasi, HNO 3 dapat direduksi menjadi berbagai produk:
4 +3 +2 +1 0 -3
N0 2 N 2 0 3 TIDAK N 2 O N 2 NH 4 N0 3
Zat mana yang terbentuk, yaitu seberapa dalam asam nitrat tereduksi dalam kasus tertentu, bergantung pada sifat zat pereduksi dan kondisi reaksi, terutama pada konsentrasi asam. Semakin tinggi konsentrasi HNO3, semakin kecil kedalaman reduksinya. Ketika bereaksi dengan asam pekat, NO2 paling sering dilepaskan. Ketika asam nitrat encer bereaksi dengan logam dengan aktivitas rendah, misalnya tembaga, NO dilepaskan. Dalam kasus logam yang lebih aktif - besi, seng - N2O terbentuk. Asam nitrat yang sangat encer bereaksi dengan logam aktif - seng, magnesium, aluminium - membentuk ion amonium, yang menghasilkan amonium nitrat dengan asam. Biasanya beberapa produk terbentuk secara bersamaan.
Cu + HN0 3(konsentrasi) - Cu(N0 3) 2 + N0 2 + H 2 0;
Cu + HN0 3 (encer) -^ Cu(N0 3) 2 + N0 + H 2 O;
Mg + HN0 3 (diencerkan) -> Mg(N0 3) 2 + N 2 0 + n 2 0;
Zn + HN0 3 (sangat encer) - Zn(N0 3) 2 + NH 4 N0 3 + H 2 0.
Ketika asam nitrat bekerja pada logam, hidrogen biasanya tidak dilepaskan.
Ketika non-logam dioksidasi, asam nitrat pekat, seperti dalam kasus logam, direduksi menjadi NO 2, misalnya
S + 6HNO 3 = H 2 S0 4 + 6N0 2 + 2H 2 0.
ZR + 5HN0 3 + 2N 2 0 = ZN 3 RO 4 + 5N0
Diagram di bawah menggambarkan kasus interaksi asam nitrat yang paling umum dengan logam dan non-logam. Secara umum, reaksi redoks yang melibatkan HNO 3 bersifat kompleks.
Campuran yang terdiri dari 1 volume asam nitrat dan 3-4 volume asam klorida pekat disebut aqua regia. Aqua regia melarutkan beberapa logam yang tidak bereaksi dengan asam nitrat, termasuk “raja logam” - emas. Tindakannya dijelaskan oleh fakta bahwa asam nitrat mengoksidasi asam klorida dengan pelepasan klorin bebas dan pembentukan nitrogen kloroksida (1N), atau nitrosil klorida, N0C1:
HN0 3 + ZNS1 = C1 2 + 2H 2 0 + N0C1.
Nitrosil klorida adalah produk antara reaksi dan terurai:
2N0C1 = 2N0 + C1 2.
Klorin pada saat pelepasannya terdiri dari atom-atom, yang menentukan tingginya kemampuan oksidasi aqua regia. Reaksi oksidasi emas dan platina berlangsung terutama menurut persamaan berikut:
Au + HN0 3 + ZNS1 = AuCl 3 + NO + 2H 2 0;
3Pt + 4HN0 3 + 12HC1 = 3PtCl 4 + 4N0 + 8H 2 0.
Asam nitrat bekerja pada banyak zat organik sedemikian rupa sehingga satu atau lebih atom hidrogen dalam molekul senyawa organik digantikan oleh gugus nitro - NO 2. Proses ini disebut nitrasi dan sangat penting dalam kimia organik.
Garam asam nitrat disebut nitrat. Semuanya larut dengan baik dalam air, dan ketika dipanaskan, mereka terurai, melepaskan oksigen. Dalam hal ini, nitrat dari logam paling aktif diubah menjadi nitrit:
2KN0 3 = 2KN0 2 +O 2
Produksi industri asam nitrat. Metode industri modern untuk memproduksi asam nitrat didasarkan pada oksidasi katalitik amonia dengan oksigen atmosfer. Ketika menjelaskan sifat-sifat amonia, ditunjukkan bahwa amonia terbakar dalam oksigen, dan produk reaksinya adalah air dan nitrogen bebas. Namun dengan adanya katalis, oksidasi amonia dengan oksigen dapat berlangsung berbeda. Jika campuran amonia dan udara dilewatkan melalui katalis, maka pada suhu 750 °C dan komposisi campuran tertentu, NH 3 hampir seluruhnya diubah menjadi N0:
4NH 3 (r) + 5O 2 (g) = 4NO(r) + 6H 2 O (g), AN = -907 kJ.
NO2 yang dihasilkan dengan mudah diubah menjadi NO2, yang jika dicampur dengan air dengan adanya oksigen atmosfer, menghasilkan asam nitrat.
Paduan berbahan dasar platina digunakan sebagai katalis untuk oksidasi amonia.
Asam nitrat yang diperoleh dari oksidasi amonia memiliki konsentrasi tidak melebihi 60%. Jika perlu, itu terkonsentrasi.
Industri ini memproduksi asam nitrat encer dengan konsentrasi 55, 47 dan 45%, dan asam nitrat pekat - 98 dan 97%. Asam pekat diangkut dalam tangki aluminium, asam encer diangkut dalam tangki yang terbuat dari baja tahan asam.
Tiket 5
2. Peranan zat besi dalam proses kehidupan tubuh.
Zat besi di dalam tubuh. Besi terdapat dalam tubuh semua hewan dan tumbuhan (rata-rata sekitar 0,02%); ini diperlukan terutama untuk metabolisme oksigen dan proses oksidatif. Ada organisme (disebut konsentrator) yang mampu mengakumulasinya dalam jumlah besar (misalnya, bakteri besi - hingga 17-20% besi). Hampir seluruh zat besi pada hewan dan tumbuhan terikat pada protein. Kekurangan zat besi menyebabkan terhambatnya pertumbuhan dan klorosis tanaman, berhubungan dengan berkurangnya pembentukan klorofil. Kelebihan zat besi juga berdampak buruk terhadap perkembangan tanaman, misalnya menyebabkan kemandulan bunga padi dan klorosis. Pada tanah basa, terbentuk senyawa besi yang tidak dapat diserap oleh akar tanaman, dan tanaman tidak menerimanya dalam jumlah yang cukup; di tanah masam, besi berubah menjadi senyawa larut dalam jumlah berlebih. Jika terdapat kekurangan atau kelebihan senyawa besi yang dapat diasimilasikan di dalam tanah, penyakit tanaman dapat terjadi di wilayah yang luas.
Zat besi masuk ke dalam tubuh hewan dan manusia melalui makanan (sumber terkaya adalah hati, daging, telur, kacang-kacangan, roti, sereal, bayam, dan bit). Biasanya, seseorang menerima 60-110 mg zat besi dalam makanannya, yang secara signifikan melebihi kebutuhan hariannya. Penyerapan zat besi yang diperoleh dari makanan terjadi di bagian atas usus kecil, kemudian memasuki darah dalam bentuk terikat protein dan dibawa bersama darah ke berbagai organ dan jaringan, di mana ia disimpan dalam bentuk zat besi. protein kompleks - feritin. Tempat penyimpanan utama zat besi dalam tubuh adalah hati dan limpa. Karena feritin, semua senyawa yang mengandung zat besi dalam tubuh disintesis: pigmen pernapasan hemoglobin disintesis di sumsum tulang, mioglobin disintesis di otot, sitokrom dan enzim yang mengandung zat besi lainnya disintesis di berbagai jaringan. Zat besi dikeluarkan dari tubuh terutama melalui dinding usus besar (pada manusia, sekitar 6-10 mg per hari) dan sebagian kecil melalui ginjal.


Terlepas dari konsentrasinya, zat pengoksidasi dalam asam nitrat adalah nitrasi NO, mengandung nitrogen dalam keadaan oksidasi +5. Oleh karena itu, ketika logam berinteraksi dengan asam nitrat, hidrogen tidak dilepaskan. Asam nitrat mengoksidasi semua logam kecuali yang paling tidak aktif (mulia). Dalam hal ini, produk reduksi garam, air dan nitrogen (+5) terbentuk: NH−3 4 NO 3, N 2, N 2 O, NO, НNO 2, NO 2. Amonia bebas tidak dilepaskan karena bereaksi dengan asam nitrat membentuk amonium nitrat:
NH 3 + HNO 3 = NH 4 NO 3
Ketika logam berinteraksi dengan asam nitrat pekat (30–60% HNO 3), produk reduksi HNO 3 sebagian besar adalah oksida nitrat (IV), terlepas dari sifat logamnya, misalnya:
Mg + 4HNO 3 (konsentrasi) = Mg(NO 3) 2 + 2NO 2 + 2H 2 O
Zn + 4HNO 3 (konsentrasi) = Zn(NO 3) 2 + 2NO 2 + 2H 2 O
Hg + 4HNO 3 (konsentrasi) = Hg(NO 3) 2 + 2NO 2 + 2H 2 O
Logam valensi variabel, ketika berinteraksi dengan asam nitrat pekat, teroksidasi ke tingkat oksidasi tertinggi. Dalam hal ini, logam-logam yang dioksidasi menjadi bilangan oksidasi +4 dan lebih tinggi membentuk asam atau oksida. Misalnya:
Sn + 4HNO 3 (konsentrasi) = H 2 SnO 3 + 4NO 2 + H 2 O
2Sb + 10HNO 3 (konsentrasi) = Sb 2 O 5 + 10NO 2 + 5H 2 O
Mo + 6HNO 3 (konsentrasi) = H 2 MoO 4 + 6NO 2 + 2H 2 O
Aluminium, kromium, besi, nikel, kobalt, titanium dan beberapa logam lainnya dipasivasi dalam asam nitrat pekat. Setelah diolah dengan asam nitrat, logam-logam ini tidak bereaksi dengan asam lain.
Ketika logam berinteraksi dengan asam nitrat encer, produk reduksinya bergantung pada sifat pereduksi logam: semakin aktif logam tersebut, semakin banyak asam nitrat yang tereduksi.
Logam aktif mereduksi asam nitrat encer secara maksimal, yaitu. terbentuk garam, air dan NH 4 NO 3, misalnya:
8K + 10HNO 3 (diencerkan) = 8KNO 3 + NH 4 NO 3 + 3H 2 O
Logam dengan aktivitas sedang, bila bereaksi dengan asam nitrat encer, membentuk garam, air dan nitrogen atau N 2 O. Semakin ke kiri logam dalam kisaran ini (semakin dekat ke aluminium), semakin besar kemungkinan terbentuknya nitrogen, misalnya :
5Mn + 12HNO 3 (diencerkan) = 5Mn(NO 3) 2 + N 2 + 6H 2 O
4Cd + 10HNO 3 (diencerkan) = 4Cd(NO 3) 2 + N 2 O + 5H 2 O
Logam dengan aktivitas rendah jika direaksikan dengan asam nitrat encer akan membentuk garam, air dan oksida nitrat (II), misalnya:
3Сu + 8HNO 3 (encer) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Tetapi persamaan reaksi dalam contoh-contoh ini bersifat kondisional, karena pada kenyataannya diperoleh campuran senyawa nitrogen, dan semakin tinggi aktivitas logam dan semakin rendah konsentrasi asam, semakin rendah bilangan oksidasi nitrogen dalam produk yang terbentuk. lebih dari yang lain.
6. Interaksi logam dengan aqua regia
Royal Vodka adalah campuran asam nitrat dan asam klorida pekat. Ini digunakan untuk mengoksidasi dan melarutkan emas, platinum dan logam mulia lainnya.
Asam klorida dalam aqua regia digunakan untuk pembentukan senyawa kompleks logam teroksidasi. Dari perbandingan setengah reaksi 29 dan 30 dengan setengah reaksi 31-32 (Tabel 1), terlihat bahwa selama pembentukan senyawa kompleks emas dan platina, potensial redoksnya menurun, sehingga memungkinkan terjadinya oksidasi dengan asam nitrat. . Persamaan reaksi emas dan platina dengan aqua regia ditulis sebagai berikut:
Au + HNO 3 + 4HCl = H + NO + 2H 2 O
3Pt + 4HNO3 + 18HCl = 3H2 + 4NO + 8H2O
Tiga logam tidak berinteraksi dengan aqua regia: tungsten, niobium, dan tantalum. Mereka dioksidasi dengan campuran asam nitrat pekat dan asam fluorida, karena asam fluorida membentuk senyawa kompleks yang lebih kuat daripada asam klorida. Persamaan reaksinya adalah sebagai berikut:
W + 2HNO3 + 8HF = H2 + 2NO + 4H2O
3Nb + 5HNO3 + 21HF = 3H2 + 5NO + 10H2O
3Ta + 5HNO3 + 24HF = 3H3 + 5NO + 10H2O
Beberapa buku teks memuat penjelasan lain tentang interaksi logam mulia dengan aqua regia. Dipercaya bahwa dalam campuran antara HNO 3 dan HCl ini terjadi reaksi yang dikatalisis oleh logam mulia, dimana asam nitrat mengoksidasi asam klorida menurut persamaan:
HNO 3 + 3HCl = NOCl + 2H 2 O
Nitrosil klorida NOCl bersifat rapuh dan terurai menurut persamaan:
NOCl = NO + Cl(atom)
Jadi, zat pengoksidasi logam adalah atom (yaitu, sangat aktif) klorin pada saat pelepasan. Oleh karena itu, produk interaksi aqua regia dengan logam adalah garam (klorida), air dan oksida nitrat (II):
Au + HNO 3 + 3HCl = AuCl 3 + NO + 2H 2 O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2O,
dan senyawa kompleks terbentuk dalam reaksi berikut:
HCl + AuCl 3 = H; 2HCl + PtCl 4 = H 2
Asam nitrat(HNO 3) adalah asam monobasa kuat. Asam nitrat padat membentuk dua modifikasi kristal dengan kisi monoklinik dan ortorombik. Asam nitrat bercampur dengan air dalam perbandingan berapa pun. Dalam larutan air, ia hampir terdisosiasi seluruhnya menjadi ion. Membentuk campuran azeotropik dengan air dengan konsentrasi 68,4% dan titik didih 120 °C pada tekanan atmosfer. Ada dua hidrat padat yang diketahui: monohidrat (HNO 3 ·H 2 O) dan trihidrat (HNO 3 ·3H 2 O).
Nitrogen dalam asam nitrat bersifat tetravalen, bilangan oksidasi +5. Asam nitrat adalah gas tidak berwarna, tidak berbau, cairan berasap di udara, titik leleh? 41.59 °C, mendidih + 82.6 °C dengan dekomposisi sebagian. Kelarutan asam nitrat dalam air tidak terbatas. Larutan HNO 3 dalam air dengan fraksi massa 0,95-0,98 disebut “asam nitrat berasap”, dengan fraksi massa 0,6-0,7 - asam nitrat pekat. Membentuk campuran azeotropik dengan air (fraksi massa 68,4%, D 20 = 1,41 g/cm, T mendidih =120,7 °C). Ketika mengkristal dari larutan berair, asam nitrat membentuk kristal hidrat:
- monohidrat HNO 3 H 2 O, Tpl =?37,62 °C
- trihidrat HNO 3 3H 2 O, Tpl =?18,47 °C
Asam nitrat padat membentuk dua modifikasi kristal:
- monoklinik, grup luar angkasa P 2 1/a, A= 1,623nm, B= 0,857nm, C= 0,631, b = 90°, Z = 16;
- · belah ketupat
Monohidrat membentuk kristal dari sistem ortorombik, kelompok ruang P tidak2, A= 0,631nm, B= 0,869nm, C= 0,544, Z = 4;
Massa jenis larutan asam nitrat dalam air sebagai fungsi konsentrasinya dijelaskan oleh persamaan
dimana d adalah massa jenis dalam g/cm, c adalah fraksi massa asam. Rumus ini kurang menggambarkan perilaku kepadatan pada konsentrasi lebih besar dari 97%.
Di bawah pengaruh cahaya, asam nitrat terurai sebagian dengan pelepasan NO 2 dan karenanya memperoleh warna coklat muda:
N 2 + O 2 pelepasan listrik petir > 2NO
- 2TIDAK + O 2 > 2TIDAK 2
- cahaya 4HNO 3 > 4NO 2^ (gas coklat)+ 2H 2 O + O 2
Asam nitrat konsentrasi tinggi melepaskan gas di udara, yang dalam botol tertutup terdeteksi sebagai uap coklat (nitrogen oksida). Gas-gas ini sangat beracun, jadi Anda harus berhati-hati agar tidak menghirupnya. Asam nitrat mengoksidasi banyak zat organik. Kertas dan kain hancur akibat oksidasi zat pembentuk bahan tersebut. Asam nitrat pekat menyebabkan luka bakar parah jika terkena dalam waktu lama dan kulit menguning selama beberapa hari jika terkena dalam waktu singkat. Menguningnya kulit menunjukkan penghancuran protein dan pelepasan belerang (reaksi kualitatif terhadap asam nitrat pekat - warna kuning karena pelepasan unsur belerang ketika asam bekerja pada protein - reaksi xanthoprotein). Artinya, itu adalah luka bakar pada kulit. Untuk mencegah luka bakar, Anda harus bekerja dengan asam nitrat pekat sambil mengenakan sarung tangan karet.
Asam nitrat dan asam nitrat serta garamnya
Asam nitrat ada dalam larutan atau dalam fase gas. Itu tidak stabil dan, ketika dipanaskan, terurai menjadi uap:
2HNO 2 “TIDAK+NO 2 +H 2 O
Larutan berair asam ini terurai ketika dipanaskan:
3HNO 2 “HNO 3 +H 2 O+2NO
Oleh karena itu, reaksi ini bersifat reversibel, meskipun pelarutan NO 2 disertai dengan pembentukan dua asam: 2NO 2 + H 2 O = HNO 2 + HNO 3
Praktisnya, dengan mereaksikan NO 2 dengan air diperoleh HNO 3:
3NO 2 +H 2 O=2HNO 3 +NO
Dari segi sifat asam, asam nitrat hanya sedikit lebih kuat dari asam asetat. Garamnya disebut nitrit dan, tidak seperti asam itu sendiri, bersifat stabil. Dari larutan garamnya, larutan HNO 2 dapat diperoleh dengan menambahkan asam sulfat:
Ba(NO 2) 2 +H 2 SO 4 =2HNO 2 +BaSO 4 ¯
Berdasarkan data senyawanya, disarankan dua jenis struktur asam nitrat:
yang sesuai dengan senyawa nitrit dan nitro. Nitrit logam aktif mempunyai struktur tipe I, dan logam aktif rendah mempunyai struktur tipe II. Hampir semua garam dari asam ini sangat larut, tetapi perak nitrit adalah yang paling sulit larut. Semua garam asam nitrat beracun. Untuk teknologi kimia, KNO 2 dan NaNO 2 penting, yang diperlukan untuk produksi pewarna organik. Kedua garam tersebut diperoleh dari nitrogen oksida:
NO+NO 2 +NaOH=2NaNO 2 +H 2 O atau saat memanaskan nitratnya:
KNO 3 +Pb=KNO 2 +PbO
Pb diperlukan untuk mengikat oksigen yang dilepaskan.
Dari sifat kimia HNO 2, sifat oksidatif lebih menonjol, sedangkan HNO sendiri tereduksi menjadi NO:

Namun, banyak contoh reaksi tersebut dapat diberikan di mana asam nitrat menunjukkan sifat pereduksi:

Keberadaan asam nitrat dan garamnya dalam suatu larutan dapat ditentukan dengan menambahkan larutan kalium iodida dan pati. Ion nitrit mengoksidasi anion yodium. Reaksi ini memerlukan kehadiran H+, yaitu. terjadi pada lingkungan asam.
Asam nitrat
Dalam kondisi laboratorium, asam nitrat dapat diperoleh dengan aksi asam sulfat pekat pada nitrat:
NaNO 3 +H 2 SO 4(k) =NaHSO 4 +HNO 3 Reaksi terjadi dengan pemanasan rendah.
Produksi asam nitrat dalam skala industri dilakukan melalui oksidasi katalitik amonia dengan oksigen atmosfer:
1. Pertama, campuran amonia dan udara dilewatkan di atas katalis platina pada suhu 800°C. Amonia dioksidasi menjadi oksida nitrat (II):
4NH 3 + 5O 2 = 4NO + 6H 2 O
2. Setelah pendinginan, oksidasi lebih lanjut dari NO terjadi menjadi NO 2: 2NO+O 2 =2NO 2
3. Nitrogen oksida (IV) yang dihasilkan larut dalam air dengan adanya kelebihan O 2 membentuk HNO 3: 4NO 2 +2H 2 O+O 2 =4HNO 3
Produk awal - amonia dan udara - dibersihkan secara menyeluruh dari kotoran berbahaya yang meracuni katalis (hidrogen sulfida, debu, minyak, dll.).
Asam yang dihasilkan bersifat encer (asam 40-60%). Asam nitrat pekat (kekuatan 96-98%) diperoleh dengan menyuling asam encer dalam campuran dengan asam sulfat pekat. Dalam hal ini, hanya asam nitrat yang menguap.
Sifat fisik
Asam nitrat adalah cairan tidak berwarna dengan bau yang menyengat. Sangat higroskopis, “asap” di udara, karena uapnya dengan kelembapan udara membentuk tetesan kabut. Bercampur dengan air dalam perbandingan berapa pun. Pada -41,6°C ia berubah menjadi kristal. Mendidih pada suhu 82,6°C.
Dalam HNO 3, valensi nitrogen adalah 4, bilangan oksidasi +5. Rumus struktur asam nitrat digambarkan sebagai berikut:
Kedua atom oksigen yang hanya terikat dengan nitrogen adalah setara: keduanya berada pada jarak yang sama dari atom nitrogen dan masing-masing membawa setengah muatan elektron, yaitu. bagian keempat nitrogen dibagi rata antara dua atom oksigen.
Struktur elektronik asam nitrat dapat disimpulkan sebagai berikut:
1. Atom hidrogen berikatan dengan atom oksigen melalui ikatan kovalen:
2. Karena elektron tidak berpasangan, atom oksigen membentuk ikatan kovalen dengan atom nitrogen:
3. Dua elektron atom nitrogen yang tidak berpasangan membentuk ikatan kovalen dengan atom oksigen kedua:
4. Atom oksigen ketiga, ketika tereksitasi, membentuk atom bebas 2p- orbital berdasarkan pasangan elektron. Interaksi pasangan elektron bebas nitrogen dengan orbital kosong atom oksigen ketiga mengarah pada pembentukan molekul asam nitrat:
Sifat kimia
1. Asam nitrat encer menunjukkan semua sifat asam. Itu milik asam kuat. Terdisosiasi dalam larutan air:
HNO 3 “Н + +NO - 3 Terurai sebagian di bawah pengaruh panas dan cahaya:
4HNO 3 =4NO 2 +2H 2 O+O 2 Oleh karena itu, simpanlah di tempat sejuk dan gelap.
2. Asam nitrat hanya mempunyai sifat pengoksidasi. Sifat kimia yang paling penting adalah interaksinya dengan hampir semua logam. Hidrogen tidak pernah dilepaskan. Reduksi asam nitrat bergantung pada konsentrasinya dan sifat zat pereduksi. Keadaan oksidasi nitrogen dalam produk reduksi berkisar antara +4 hingga -3:
HN +5 O 3 ®N +4 O 2 ®HN +3 O 2 ®N +2 O®N +1 2 O®N 0 2 ®N -3 H 4 NO 3
Produk reduksi dari interaksi asam nitrat dengan konsentrasi berbeda dengan logam dengan aktivitas berbeda ditunjukkan pada diagram di bawah.

Asam nitrat pekat pada suhu biasa tidak berinteraksi dengan aluminium, kromium, dan besi. Ini menempatkan mereka dalam keadaan pasif. Lapisan oksida terbentuk di permukaan, yang kedap terhadap asam pekat.

3. Asam nitrat tidak bereaksi dengan Pt, Rh, Ir, Ta, Au. Platinum dan emas dilarutkan dalam "aqua regia" - campuran 3 volume asam klorida pekat dan 1 volume asam nitrat pekat:
Au+HNO 3 +3HCl= AuCl 3 +NO+2H 2 O HCl+AuCl 3 =H
3Pt+4HNO 3 +12HCl=3PtCl 4 +4NO+8H 2 O 2HCl+PtCl 4 =H 2
Efek dari “regia vodka” adalah asam nitrat mengoksidasi asam klorida menjadi klorin bebas:
HNO 3 +HCl=Cl 2 +2H 2 O+NOCl 2NOCl=2NO+Cl 2 Klorin yang dilepaskan akan bergabung dengan logam.
4. Non-logam dioksidasi dengan asam nitrat menjadi asam yang sesuai, dan tergantung pada konsentrasinya, ia direduksi menjadi NO atau NO 2:
S+bHNO 3(konsentrasi) =H 2 SO 4 +6NO 2 +2H 2 OP+5HNO 3(konsentrasi) =H 3 PO 4 +5NO 2 +H 2 O I 2 +10HNO 3(konsentrasi) =2HIO 3 +10NO 2 +4H 2 O 3P+5HNO 3(p asb) +2H 2 O= 3H 3 PO 4 +5NO
5. Ia juga berinteraksi dengan senyawa organik.
Garam asam nitrat disebut nitrat dan merupakan zat kristal yang sangat larut dalam air. Mereka diperoleh melalui aksi HNO 3 pada logam, oksida dan hidroksidanya. Kalium, natrium, amonium dan kalsium nitrat disebut nitrat. Nitrat digunakan terutama sebagai pupuk nitrogen mineral. Selain itu, KNO 3 digunakan untuk membuat bubuk hitam (campuran 75% KNO 3, 15% C dan 10% S). Ammonal peledak terbuat dari NH 4 NO 3, bubuk aluminium dan trinitrotoluena.
Garam asam nitrat terurai ketika dipanaskan, dan produk penguraiannya bergantung pada posisi logam pembentuk garam dalam rangkaian potensial elektroda standar:

Dekomposisi ketika dipanaskan (termolisis) merupakan sifat penting dari garam asam nitrat.
2KNO 3 =2KNO 2 +O 2
2Cu(NO 3) 2 = 2CuO+NO 2 +O 2
Garam logam yang terletak pada deret di sebelah kiri Mg membentuk nitrit dan oksigen, dari Mg menjadi Cu - oksida logam, NO 2 dan oksigen, setelah logam bebas Cu, NO 2 dan oksigen.
Aplikasi
Asam nitrat adalah produk terpenting dari industri kimia. Sejumlah besar dihabiskan untuk pembuatan pupuk nitrogen, bahan peledak, pewarna, plastik, serat buatan dan bahan lainnya. Merokok
Asam nitrat digunakan dalam teknologi roket sebagai oksidator bahan bakar roket.
Telah dibuktikan secara eksperimental bahwa dalam molekul asam nitrat antara dua atom oksigen dan satu atom nitrogen, terdapat dua ikatan kimia yang benar-benar identik - ikatan satu setengah. Bilangan oksidasi nitrogen adalah +5, dan valensinya adalah IV.
Sifat fisik
Asam nitrat HNO3 dalam bentuknya yang murni - cairan tidak berwarna dengan bau menyesakkan yang tajam, sangat larut dalam air; t°pl.= -41°C; t°mendidih = 82,6°C, r = 1,52 g/cm 3 . Ini terbentuk dalam jumlah kecil selama pelepasan petir dan terdapat dalam air hujan.
Di bawah pengaruh cahaya, sebagian asam nitrat terurai dan dilepaskan N O 2 dan untuk CBahkan setelah itu warnanya menjadi coklat muda:
N 2 + O 2 badai petir el.
angka → 2TIDAK
2NO + O 2 → 2NO 2 cahaya 4H N O 3 → 4 N HAI 2(gas coklat)
+ 2H 2 O + O 2
Asam nitrat konsentrasi tinggi melepaskan gas di udara, yang dalam botol tertutup terdeteksi sebagai uap coklat (nitrogen oksida). Gas-gas ini sangat beracun, jadi Anda harus berhati-hati agar tidak menghirupnya. Asam nitrat mengoksidasi banyak zat organik. Kertas dan kain hancur akibat oksidasi zat pembentuk bahan tersebut. Asam nitrat pekat menyebabkan luka bakar parah jika terkena dalam waktu lama dan kulit menguning selama beberapa hari jika terkena dalam waktu singkat. Menguningnya kulit menunjukkan penghancuran protein dan pelepasan belerang (reaksi kualitatif terhadap asam nitrat pekat - warna kuning karena pelepasan unsur belerang ketika asam bekerja pada protein - reaksi xanthoprotein). Artinya, itu adalah luka bakar pada kulit. Untuk mencegah luka bakar, Anda harus bekerja dengan asam nitrat pekat sambil mengenakan sarung tangan karet.
Kuitansi
1. Metode laboratorium KNO 3 + H 2 SO 4 (konsentrasi) → KHSO 4 + HNO 3
2. Metode industri
Itu dilakukan dalam tiga tahap:
a) Oksidasi amonia pada katalis platina menjadi NO
4NH 3 + 5O 2 → 4NO + 6H 2 O (Kondisi: katalis – Pt, t = 500˚С)
b) Oksidasi NO menjadi NO 2 oleh oksigen atmosfer
2NO + O 2 → 2NO 2
c) Penyerapan NO 2 oleh air dengan adanya oksigen berlebih
4NO 2 + O 2 + 2H 2 O ↔ 4HNO 3
atau3 NO 2 + H 2 O ↔ 2 HNO 3 + NO (tanpa oksigen berlebih)
Simulator "Produksi asam nitrat"
Aplikasi
- dalam produksi pupuk mineral;
- di industri militer;
- dalam fotografi - pengasaman beberapa larutan pewarna;
- dalam grafik kuda-kuda - untuk mengetsa formulir pencetakan (papan etsa, formulir pencetakan zincografik, dan klise magnesium).
- dalam produksi bahan peledak dan zat beracun
Pertanyaan untuk kontrol:
No.1. Keadaan oksidasi atom nitrogen dalam molekul asam nitrat
A. +4
B. +3
C. +5
D. +2
No.2. Atom nitrogen dalam molekul asam nitrat memiliki valensi sama dengan -
A. II
B. V
C. IV
D. AKU AKU AKU
Nomor 3. Sifat fisik apa yang menjadi ciri asam nitrat murni?
A. tidak ada warna
B. tidak berbau
C. memiliki bau menjengkelkan yang kuat
D. cairan berasap
e. dicat kuning
Nomor 4. Cocokkan bahan awal dan produk reaksi:
|
a) NH3 + O2 |
1) TIDAK 2 |
|
b) KNO 3 + H 2 JADI 4 |
2) TIDAK 2 + O 2 + H 2 O |
|
c) HNO3 |
3) TIDAK + H 2 O |
|
d) TIDAK + O 2 |
4)KHSO 4 + HNO 3 |
Nomor 5. Susunlah koefisien-koefisien dengan menggunakan metode keseimbangan elektron, tunjukkan transisi elektron, tunjukkan proses oksidasi (reduksi; zat pengoksidasi (reduktor):
NO 2 + O 2 + H 2 O ↔ HNO 3