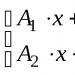Banyak proses yang tanpanya mustahil membayangkan kehidupan kita (seperti respirasi, pencernaan, fotosintesis, dan sejenisnya) berhubungan dengan berbagai reaksi kimia senyawa organik (dan anorganik). Mari kita lihat tipe utamanya dan lihat lebih dekat proses yang disebut koneksi (attachment).
Apa itu reaksi kimia?
Pertama-tama, ada baiknya memberikan definisi umum tentang fenomena ini. Ungkapan yang dimaksud mengacu pada berbagai reaksi zat dengan kompleksitas yang berbeda-beda, yang menghasilkan pembentukan produk yang berbeda dari produk aslinya. Zat yang terlibat dalam proses ini disebut “reagen”.
Secara tertulis, reaksi kimia senyawa organik (dan anorganik) ditulis menggunakan persamaan khusus. Secara lahiriah, mereka terlihat seperti contoh penjumlahan matematika. Namun, panah ("→" atau "⇆") digunakan sebagai pengganti tanda sama dengan ("="). Selain itu, terkadang terdapat lebih banyak zat di sisi kanan persamaan dibandingkan di sisi kiri. Segala sesuatu yang sebelum tanda panah adalah zat sebelum reaksi dimulai (sisi kiri rumus). Segala sesuatu setelahnya (kanan) merupakan senyawa yang terbentuk akibat proses kimia yang terjadi.
Sebagai contoh persamaan kimia, kita dapat mengubah air menjadi hidrogen dan oksigen di bawah pengaruh arus listrik: 2H 2 O → 2H 2 + O 2. Air adalah reaktan awal, dan oksigen serta hidrogen adalah produknya.
Sebagai contoh lain, namun lebih kompleks dari reaksi kimia senyawa, kita dapat mempertimbangkan fenomena yang akrab bagi setiap ibu rumah tangga yang pernah membuat kue manisan setidaknya sekali. Kita berbicara tentang memadamkan soda kue dengan cuka meja. Aksi yang terjadi diilustrasikan dengan persamaan berikut: NaHCO 3 + 2 CH 3 COOH → 2CH 3 COONa + CO 2 + H 2 O. Jelas dari situ bahwa selama interaksi natrium bikarbonat dan cuka, garam natrium asam asetat , air dan karbon dioksida terbentuk.
Berdasarkan sifatnya, ia menempati tempat peralihan antara fisik dan nuklir.
Berbeda dengan senyawa sebelumnya, senyawa yang berpartisipasi dalam reaksi kimia mampu mengubah komposisinya. Artinya, dari atom-atom suatu zat, beberapa zat lain dapat dibentuk, seperti dalam persamaan penguraian air yang disebutkan di atas.
Berbeda dengan reaksi nuklir, reaksi kimia tidak mempengaruhi inti atom zat yang berinteraksi.
Apa saja jenis proses kimia?
Distribusi reaksi senyawa menurut jenisnya terjadi menurut kriteria yang berbeda:

- Reversibilitas/ireversibilitas.
- Ada/tidaknya zat dan proses katalitik.
- Dengan penyerapan/pelepasan panas (reaksi endotermik/eksotermik).
- Berdasarkan jumlah fase: homogen/heterogen dan dua varietas hibrida.
- Dengan mengubah bilangan oksidasi zat yang berinteraksi.
Jenis proses kimia menurut cara interaksinya
Kriteria ini istimewa. Dengan bantuannya, empat jenis reaksi dibedakan: koneksi, substitusi, dekomposisi (pembelahan) dan pertukaran.

Nama masing-masing sesuai dengan proses yang dijelaskannya. Artinya, mereka bergabung, dalam substitusi mereka berubah ke kelompok lain, dalam dekomposisi beberapa reagen terbentuk, dan sebagai imbalannya para peserta dalam reaksi bertukar atom satu sama lain.
Jenis proses menurut metode interaksi dalam kimia organik
Meskipun sangat kompleks, reaksi senyawa organik terjadi menurut prinsip yang sama dengan reaksi anorganik. Namun keduanya memiliki nama yang sedikit berbeda.
Jadi, reaksi penggabungan dan penguraian disebut “penambahan”, serta “eliminasi” (eliminasi) dan penguraian organik langsung (dalam bagian kimia ini ada dua jenis proses pemisahan).
Reaksi senyawa organik lainnya adalah substitusi (namanya tidak berubah), penataan ulang (pertukaran) dan proses redoks. Meskipun mekanisme kemunculannya serupa, dalam bahan organik mereka lebih beragam.
Reaksi kimia suatu senyawa
Setelah mempertimbangkan berbagai jenis proses masuknya zat ke dalam kimia organik dan anorganik, ada baiknya memikirkan lebih detail tentang senyawa tersebut.
Reaksi ini berbeda dari reaksi lainnya karena, berapa pun jumlah reagen di awal, pada akhirnya semuanya bergabung menjadi satu.
Sebagai contoh, kita dapat mengingat proses slaking kapur: CaO + H 2 O → Ca(OH) 2. Dalam hal ini terjadi reaksi antara kalsium oksida (kapur) dan hidrogen oksida (air). Akibatnya, kalsium hidroksida (kapur mati) terbentuk dan uap hangat keluar. Omong-omong, ini berarti proses ini benar-benar eksotermik.
Persamaan Reaksi Majemuk
Secara skematis proses yang dipertimbangkan dapat digambarkan sebagai berikut: A + BV → ABC. Dalam rumus ini, ABC adalah pereaksi A yang baru terbentuk, dan BV adalah varian senyawa kompleks.

Perlu dicatat bahwa rumus ini juga merupakan ciri dari proses penjumlahan dan penggabungan.
Contoh reaksi yang dipertimbangkan adalah interaksi natrium oksida dan karbon dioksida (NaO 2 + CO 2 (t 450-550 ° C) → Na 2 CO 3), serta sulfur oksida dengan oksigen (2SO 2 + O 2 → 2JADI 3).
Beberapa senyawa kompleks juga mampu bereaksi satu sama lain: AB + VG → ABVG. Misalnya natrium oksida dan hidrogen oksida yang sama: NaO 2 + H 2 O → 2NaOH.
Kondisi reaksi pada senyawa anorganik
Seperti yang ditunjukkan dalam persamaan sebelumnya, zat dengan tingkat kompleksitas yang berbeda-beda dapat masuk ke dalam interaksi yang dipertimbangkan.

Selain itu, untuk reagen sederhana yang berasal dari anorganik, reaksi redoks senyawa (A + B → AB) dimungkinkan.
Sebagai contoh, kita dapat memperhatikan proses memperoleh trivalen. Untuk ini, reaksi senyawa dilakukan antara klorin dan ferum (besi): 3Cl 2 + 2Fe → 2FeCl 3.
Jika kita berbicara tentang interaksi zat anorganik kompleks (AB + VG → ABVG), proses di dalamnya dapat terjadi, baik yang mempengaruhi maupun tidak mempengaruhi valensinya.
Sebagai gambaran, patut diperhatikan contoh pembentukan kalsium bikarbonat dari karbon dioksida, hidrogen oksida (air) dan pewarna makanan putih E170 (kalsium karbonat): CO 2 + H 2 O + CaCO 3 → Ca (CO 3) 2. Dalam hal ini, yang terjadi adalah reaksi senyawa klasik. Selama pelaksanaannya, valensi reagen tidak berubah.
Persamaan kimia yang sedikit lebih maju (daripada yang pertama) 2FeCl 2 + Cl 2 → 2FeCl 3 adalah contoh proses redoks selama interaksi reagen anorganik sederhana dan kompleks: gas (klorin) dan garam (besi klorida).
Jenis reaksi adisi dalam kimia organik
Sebagaimana telah disebutkan pada paragraf keempat, pada zat yang berasal dari organik, reaksi yang dimaksud disebut “tambahan”. Biasanya, zat kompleks dengan ikatan rangkap (atau rangkap tiga) ikut ambil bagian di dalamnya.

Misalnya reaksi antara dibromin dan etilen yang menghasilkan pembentukan 1,2-dibromoetana: (C 2 H 4) CH 2 = CH 2 + Br 2 → (C₂H₄Br₂) BrCH 2 - CH 2 Br. Omong-omong, tanda yang mirip dengan sama dengan dan minus (“=” dan “-”) dalam persamaan ini menunjukkan ikatan antar atom suatu zat kompleks. Inilah ciri penulisan rumus zat organik.
Tergantung pada senyawa mana yang bertindak sebagai reagen, ada beberapa jenis proses adisi yang dipertimbangkan:
- Hidrogenasi (molekul hidrogen H ditambahkan pada ikatan rangkap).
- Hidrohalogenasi (ditambahkan hidrogen halida).
- Halogenasi (penambahan halogen Br 2, Cl 2 dan sejenisnya).
- Polimerisasi (pembentukan zat dengan berat molekul tinggi dari beberapa senyawa dengan berat molekul rendah).
Contoh reaksi adisi (senyawa)
Setelah membuat daftar jenis-jenis proses yang sedang dipertimbangkan, ada baiknya mempelajari beberapa contoh reaksi majemuk dalam praktik.
Sebagai gambaran hidrogenasi, perhatikan persamaan interaksi propena dengan hidrogen yang menghasilkan propana: (C 3 H 6 ) CH 3 -CH = CH 2 + H 2 → (C 3 H 8 ) CH 3 -CH 2 -CH 3.
Dalam kimia organik, reaksi peracikan (adisi) dapat terjadi antara asam klorida (zat anorganik) dan etilen membentuk kloroetana: (C 2 H 4 ) CH 2 = CH 2 + HCl → CH 3 - CH 2 -Cl (C 2 H5Cl). Persamaan yang disajikan adalah contoh hidrohalogenasi.

Adapun halogenasi dapat diilustrasikan dengan reaksi antara diklorin dan etilen yang menghasilkan pembentukan 1,2-dikloroetana: (C 2 H 4 ) CH 2 = CH 2 + Cl 2 → (C₂H₄Cl₂) ClCH 2 -CH 2 Kl.
Banyak zat bermanfaat terbentuk berkat kimia organik. Reaksi penggabungan (adisi) molekul etilen dengan inisiator radikal polimerisasi di bawah pengaruh sinar ultraviolet menegaskan hal ini: n CH 2 = CH 2 (R dan sinar UV) → (-CH 2 -CH 2 -)n. Zat yang terbentuk dengan cara ini sudah diketahui setiap orang dengan nama polietilen.

Berbagai jenis kemasan, tas, piring, pipa, bahan isolasi dan masih banyak lagi dibuat dari bahan ini. Ciri khusus zat ini adalah kemungkinan didaur ulang. Polietilen mendapatkan popularitasnya karena fakta bahwa ia tidak terurai, itulah sebabnya para pencinta lingkungan memiliki sikap negatif terhadapnya. Namun, dalam beberapa tahun terakhir, cara untuk membuang produk polietilen dengan aman telah ditemukan. Untuk melakukan ini, bahan tersebut diolah dengan asam nitrat (HNO 3). Setelah itu jenis bakteri tertentu mampu menguraikan zat tersebut menjadi komponen yang aman.
Reaksi koneksi (penjumlahan) memegang peranan penting dalam alam dan kehidupan manusia. Selain itu, sering digunakan oleh para ilmuwan di laboratorium untuk mensintesis zat baru untuk berbagai penelitian penting.
Reaksi kimia, sifat-sifatnya, jenisnya, kondisi terjadinya, dan lain-lain, merupakan salah satu pilar utama ilmu pengetahuan menarik yang disebut kimia. Mari kita coba mencari tahu apa itu reaksi kimia dan apa perannya. Jadi, reaksi kimia dalam kimia dianggap sebagai transformasi satu atau lebih zat menjadi zat lain. Dalam hal ini, inti mereka tidak berubah (tidak seperti reaksi nuklir), tetapi terjadi redistribusi elektron dan inti, dan, tentu saja, unsur kimia baru muncul.
Reaksi kimia di alam dan kehidupan sehari-hari
Anda dan saya dikelilingi oleh reaksi kimia, apalagi kita sendiri yang rutin melakukannya melalui berbagai tindakan sehari-hari, misalnya kita menyalakan korek api. Juru masak, tanpa menyadarinya (atau bahkan mungkin mencurigainya), melakukan banyak reaksi kimia saat menyiapkan makanan.
Tentu saja, banyak reaksi kimia terjadi dalam kondisi alami: letusan gunung berapi, dedaunan dan pepohonan, tetapi apa yang bisa saya katakan, hampir semua proses biologis dapat diklasifikasikan sebagai contoh reaksi kimia.
Jenis reaksi kimia
Semua reaksi kimia dapat dibagi menjadi sederhana dan kompleks. Reaksi kimia sederhana, pada gilirannya, dibagi menjadi:
- reaksi koneksi,
- reaksi dekomposisi,
- reaksi substitusi,
- reaksi pertukaran.
Reaksi kimia suatu senyawa
Menurut definisi yang sangat tepat dari ahli kimia besar D.I. Mendeleev, reaksi senyawa terjadi ketika “salah satu dari dua zat” terjadi. Contoh reaksi kimia suatu senyawa adalah pemanasan serbuk besi dan belerang, dimana besi sulfida terbentuk darinya - Fe + S = FeS. Contoh mencolok lainnya dari reaksi ini adalah pembakaran zat sederhana seperti belerang atau fosfor di udara (mungkin reaksi seperti itu juga bisa disebut reaksi kimia termal).
Reaksi kimia penguraian
Semuanya sederhana di sini, reaksi dekomposisi adalah kebalikan dari reaksi senyawa. Dengan bantuannya, dua zat atau lebih diperoleh dari satu zat. Contoh sederhana dari reaksi penguraian kimia adalah reaksi penguraian kapur, di mana kapur tohor dan karbon dioksida terbentuk dari kapur itu sendiri.
Reaksi substitusi kimia
Reaksi substitusi terjadi ketika zat sederhana berinteraksi dengan zat kompleks. Mari kita beri contoh reaksi substitusi kimia: jika kita mencelupkan paku baja ke dalam larutan tembaga sulfat, maka melalui percobaan kimia sederhana ini kita akan memperoleh besi sulfat (besi akan menggantikan tembaga dari garam). Persamaan reaksi kimia tersebut akan terlihat seperti ini:
Fe+CuSO 4 → FeSO 4 + Cu
Reaksi pertukaran kimia
Reaksi pertukaran terjadi secara eksklusif antara zat-zat kimia kompleks, di mana mereka bertukar bagian-bagiannya. Banyak reaksi seperti itu terjadi dalam berbagai larutan. Netralisasi asam oleh empedu adalah contoh yang baik dari reaksi metabolisme kimia.
NaOH+HCl→ NaCl+H 2 O
Ini adalah persamaan kimia untuk reaksi ini, dimana ion hidrogen dari senyawa HCl menukar ion natrium dari senyawa NaOH. Akibat dari reaksi kimia ini adalah terbentuknya larutan garam meja.
Tanda-tanda reaksi kimia
Dari tanda-tanda terjadinya reaksi kimia, seseorang dapat menilai apakah telah terjadi reaksi kimia antar reagen atau belum. Berikut contoh tanda-tanda reaksi kimia:
- Perubahan warna (besi ringan, misalnya, menjadi tertutup lapisan coklat di udara lembab, akibat reaksi kimia antara besi dan).
- Curah hujan (jika Anda tiba-tiba melewatkan karbon dioksida melalui larutan kapur, Anda akan mendapatkan endapan putih kalsium karbonat yang tidak larut).
- Pelepasan gas (jika Anda memasukkan asam sitrat ke dalam soda kue, Anda akan melepaskan karbon dioksida).
- Pembentukan zat yang terdisosiasi lemah (semua reaksi yang menghasilkan pembentukan air).
- Cahaya larutan (contohnya di sini adalah reaksi yang terjadi dengan larutan luminol, yang memancarkan cahaya selama reaksi kimia).
Secara umum, sulit untuk mengidentifikasi tanda-tanda reaksi kimia mana yang utama; zat yang berbeda dan reaksi yang berbeda memiliki karakteristiknya masing-masing.
Cara mengidentifikasi tanda-tanda reaksi kimia
Anda dapat menentukan tanda suatu reaksi kimia secara visual (dengan mengubah warna, bersinar), atau dengan hasil dari reaksi tersebut.
Laju reaksi kimia
Laju reaksi kimia biasanya dipahami sebagai perubahan jumlah salah satu zat yang bereaksi per satuan waktu. Apalagi laju reaksi kimia selalu bernilai positif. Pada tahun 1865, ahli kimia N. N. Beketov merumuskan hukum aksi massa, yang menyatakan bahwa “laju reaksi kimia pada setiap momen waktu sebanding dengan konsentrasi reagen yang dipangkatkan sama dengan koefisien stoikiometrinya.”
Faktor-faktor yang mempengaruhi laju reaksi kimia antara lain:
- sifat reaktan,
- adanya katalis,
- suhu,
- tekanan,
- luas permukaan zat yang bereaksi.
Semuanya mempunyai pengaruh yang sangat langsung terhadap laju reaksi kimia.
Kesetimbangan reaksi kimia
Kesetimbangan kimia adalah keadaan sistem kimia di mana beberapa reaksi kimia terjadi dan laju setiap pasangan reaksi maju dan mundur adalah sama. Dengan demikian, konstanta kesetimbangan suatu reaksi kimia diidentifikasi - ini adalah besaran yang menentukan hubungan antara aktivitas termodinamika zat awal dan produk dalam keadaan kesetimbangan kimia untuk reaksi kimia tertentu. Mengetahui konstanta kesetimbangan, Anda dapat menentukan arah reaksi kimia.
Kondisi terjadinya reaksi kimia
Untuk memulai reaksi kimia, perlu diciptakan kondisi yang sesuai:
- membawa zat ke dalam kontak dekat.
- memanaskan zat sampai suhu tertentu (suhu reaksi kimia harus sesuai).
Efek termal dari reaksi kimia
Ini adalah nama yang diberikan untuk perubahan energi dalam suatu sistem sebagai akibat terjadinya reaksi kimia dan perubahan zat awal (reaktan) menjadi produk reaksi dalam jumlah yang sesuai dengan persamaan reaksi kimia berikut ini. ketentuan:
- Satu-satunya pekerjaan yang mungkin dilakukan dalam hal ini hanyalah bekerja melawan tekanan eksternal.
- zat awal dan produk yang diperoleh dari reaksi kimia mempunyai suhu yang sama.
Reaksi kimia, video
Dan sebagai penutup, video menarik tentang reaksi kimia yang paling menakjubkan.
DEFINISI
Reaksi kimia disebut transformasi zat yang didalamnya terjadi perubahan komposisi dan (atau) strukturnya.
Paling sering, reaksi kimia dipahami sebagai proses mengubah zat awal (reagen) menjadi zat akhir (produk).
Reaksi kimia ditulis menggunakan persamaan kimia yang memuat rumus zat awal dan hasil reaksi. Menurut hukum kekekalan massa, jumlah atom setiap unsur pada ruas kiri dan kanan persamaan kimia adalah sama. Biasanya rumus zat awal ditulis di sisi kiri persamaan, dan rumus produk di sebelah kanan. Kesetaraan jumlah atom setiap unsur pada ruas kiri dan kanan persamaan dicapai dengan menempatkan koefisien stoikiometri bilangan bulat di depan rumus zat.
Persamaan kimia mungkin berisi informasi tambahan tentang karakteristik reaksi: suhu, tekanan, radiasi, dll., yang ditunjukkan dengan simbol yang sesuai di atas (atau “di bawah”) tanda sama dengan.
Semua reaksi kimia dapat dikelompokkan menjadi beberapa kelas, yang mempunyai ciri-ciri tertentu.
Klasifikasi reaksi kimia menurut jumlah dan komposisi zat awal dan zat yang dihasilkan
Menurut klasifikasi ini, reaksi kimia dibagi menjadi reaksi penyambungan, dekomposisi, substitusi, dan pertukaran.
Sebagai akibat reaksi majemuk dari dua atau lebih zat (kompleks atau sederhana) terbentuk satu zat baru. Secara umum persamaan reaksi kimia tersebut akan terlihat seperti ini:
Misalnya:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2
JADI 3 + H 2 O = H 2 JADI 4
2Mg + O 2 = 2MgO.
2FeCl 2 + Cl 2 = 2FeCl 3
Reaksi senyawa dalam banyak kasus bersifat eksotermik, yaitu. dilanjutkan dengan pelepasan panas. Jika zat sederhana terlibat dalam reaksi, maka reaksi tersebut paling sering merupakan reaksi redoks (ORR), yaitu. terjadi dengan perubahan bilangan oksidasi unsur. Tidak mungkin untuk mengatakan dengan pasti apakah reaksi suatu senyawa antara zat kompleks akan diklasifikasikan sebagai ORR.
Reaksi yang menghasilkan pembentukan beberapa zat baru lainnya (kompleks atau sederhana) dari satu zat kompleks diklasifikasikan sebagai reaksi dekomposisi. Secara umum persamaan reaksi kimia penguraian akan terlihat seperti ini:
Misalnya:
CaCO 3 CaO + CO 2 (1)
2H 2 O = 2H 2 + O 2 (2)
CuSO 4 × 5H 2 O = CuSO 4 + 5H 2 O (3)
Cu(OH) 2 = CuO + H 2 O (4)
H 2 SiO 3 = SiO 2 + H 2 O (5)
2JADI 3 =2JADI 2 + O 2 (6)
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 +4H 2 O (7)
Sebagian besar reaksi dekomposisi terjadi ketika dipanaskan (1,4,5). Kemungkinan penguraian di bawah pengaruh arus listrik (2). Penguraian kristal hidrat, asam, basa dan garam dari asam yang mengandung oksigen (1, 3, 4, 5, 7) terjadi tanpa mengubah bilangan oksidasi unsur-unsurnya, yaitu. reaksi ini tidak berhubungan dengan ODD. Reaksi penguraian ORR meliputi penguraian oksida, asam dan garam yang dibentuk oleh unsur-unsur dengan bilangan oksidasi lebih tinggi (6).
Reaksi penguraian juga ditemukan dalam kimia organik, tetapi dengan nama lain - perengkahan (8), dehidrogenasi (9):
C 18 H 38 = C 9 H 18 + C 9 H 20 (8)
C 4 H 10 = C 4 H 6 + 2H 2 (9)
Pada reaksi substitusi zat sederhana berinteraksi dengan zat kompleks sehingga membentuk zat sederhana baru dan zat kompleks baru. Secara umum persamaan reaksi substitusi kimia akan terlihat seperti ini:
Misalnya:
2Al + Fe 2 O 3 = 2Fe + Al 2 O 3 (1)
Zn + 2HCl = ZnСl 2 + H 2 (2)
2KBr + Cl 2 = 2KCl + Br 2 (3)
2KlO 3 + aku 2 = 2KlO 3 + Cl 2 (4)
CaCO3 + SiO2 = CaSiO3 + CO2 (5)
Ca 3 (PO 4) 2 + 3SiO 2 = 3СаSiO 3 + P 2 O 5 (6)
CH 4 + Cl 2 = CH 3 Cl + HCl (7)
Sebagian besar reaksi substitusi adalah redoks (1 – 4, 7). Contoh reaksi dekomposisi yang tidak terjadi perubahan bilangan oksidasi hanya sedikit (5, 6).
Pertukaran reaksi adalah reaksi yang terjadi antara zat kompleks dimana zat tersebut menukar bagian penyusunnya. Biasanya istilah ini digunakan untuk reaksi yang melibatkan ion dalam larutan air. Secara umum persamaan reaksi pertukaran kimia akan terlihat seperti ini:
AB + CD = IKLAN + CB
Misalnya:
CuO + 2HCl = CuCl 2 + H 2 O (1)
NaOH + HCl = NaCl + H 2 O (2)
NaHCO 3 + HCl = NaCl + H 2 O + CO 2 (3)
AgNO 3 + KBr = AgBr ↓ + KNO 3 (4)
CrCl 3 + ZNaON = Cr(OH) 3 ↓+ ZNaCl (5)
Reaksi pertukaran bukanlah redoks. Kasus khusus dari reaksi pertukaran ini adalah reaksi netralisasi (reaksi asam dengan basa) (2). Reaksi pertukaran berlangsung ke arah di mana setidaknya salah satu zat dikeluarkan dari bidang reaksi dalam bentuk zat gas (3), endapan (4, 5) atau senyawa yang sulit terdisosiasi, paling sering air (1, 2 ).
Klasifikasi reaksi kimia menurut perubahan bilangan oksidasi
Bergantung pada perubahan bilangan oksidasi unsur-unsur yang menyusun reagen dan produk reaksi, semua reaksi kimia dibagi menjadi reaksi redoks (1, 2) dan reaksi yang terjadi tanpa mengubah bilangan oksidasi (3, 4).
2Mg + CO 2 = 2MgO + C (1)
Mg 0 – 2e = Mg 2+ (zat pereduksi)
C 4+ + 4e = C 0 (zat pengoksidasi)
FeS 2 + 8HNO 3 (konsentrasi) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O (2)
Fe 2+ -e = Fe 3+ (zat pereduksi)
N 5+ +3e = N 2+ (zat pengoksidasi)
AgNO 3 +HCl = AgCl ↓ + HNO 3 (3)
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ↓ + H 2 O (4)
Klasifikasi reaksi kimia berdasarkan efek termal
Bergantung pada apakah panas (energi) dilepaskan atau diserap selama reaksi, semua reaksi kimia secara kondisional dibagi menjadi eksotermik (1, 2) dan endotermik (3). Banyaknya kalor (energi) yang dilepaskan atau diserap selama suatu reaksi disebut efek termal reaksi. Jika persamaan tersebut menunjukkan banyaknya kalor yang dilepaskan atau diserap, maka persamaan tersebut disebut termokimia.
N 2 + 3H 2 = 2NH 3 +46,2 kJ (1)
2Mg + O 2 = 2MgO + 602,5 kJ (2)
N 2 + O 2 = 2NO – 90,4 kJ (3)
Klasifikasi reaksi kimia menurut arah reaksinya
Berdasarkan arah reaksinya, dibedakan antara reversibel (proses kimia yang produknya mampu bereaksi satu sama lain dalam kondisi yang sama saat diperoleh untuk membentuk zat awal) dan ireversibel (proses kimia yang produknya tidak mampu bereaksi satu sama lain untuk membentuk zat awal).
Untuk reaksi reversibel, persamaan dalam bentuk umum biasanya ditulis sebagai berikut:
A + B ↔ AB
Misalnya:
CH 3 COOH + C 2 H 5 OH ↔ H 3 COOC 2 H 5 + H 2 O
Contoh reaksi ireversibel adalah reaksi berikut:
2КlО 3 → 2Кl + ЗО 2
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O
Bukti reaksi yang tidak dapat diubah dapat berupa pelepasan zat gas, endapan, atau senyawa yang sulit terdisosiasi, paling sering air, sebagai produk reaksi.
Klasifikasi reaksi kimia menurut keberadaan katalis
Dari sudut pandang ini, reaksi katalitik dan non-katalitik dibedakan.
Katalis adalah zat yang mempercepat berlangsungnya suatu reaksi kimia. Reaksi yang terjadi dengan partisipasi katalis disebut katalitik. Beberapa reaksi tidak dapat berlangsung tanpa adanya katalis:
2H 2 O 2 = 2H 2 O + O 2 (katalis MnO 2)
Seringkali salah satu produk reaksi berfungsi sebagai katalis yang mempercepat reaksi ini (reaksi autokatalitik):
MeO+ 2HF = MeF 2 + H 2 O, dimana Me adalah logam.
Contoh pemecahan masalah
CONTOH 1
Klasifikasi reaksi kimia dalam kimia anorganik dan organik dilakukan berdasarkan berbagai karakteristik klasifikasi, informasinya diberikan pada tabel di bawah ini.
Dengan mengubah bilangan oksidasi unsur
Tanda klasifikasi pertama didasarkan pada perubahan bilangan oksidasi unsur-unsur pembentuk reaktan dan produk.
a) redoks
b) tanpa mengubah bilangan oksidasi
Redoks disebut reaksi yang disertai dengan perubahan bilangan oksidasi unsur-unsur kimia penyusun reagen. Reaksi redoks dalam kimia anorganik mencakup semua reaksi substitusi dan reaksi dekomposisi dan kombinasi yang melibatkan setidaknya satu zat sederhana. Reaksi yang terjadi tanpa perubahan bilangan oksidasi unsur-unsur pembentuk reaktan dan produk reaksi mencakup semua reaksi pertukaran.

Menurut jumlah dan komposisi reagen dan produk
Reaksi kimia diklasifikasikan berdasarkan sifat prosesnya, yaitu berdasarkan jumlah dan komposisi reagen dan produk.
Reaksi majemuk adalah reaksi kimia yang menghasilkan molekul kompleks dari beberapa molekul yang lebih sederhana, misalnya:
4Li + O 2 = 2Li 2 O
Reaksi penguraian disebut reaksi kimia yang menghasilkan molekul sederhana dari molekul yang lebih kompleks, misalnya:
CaCO3 = CaO + CO2
Reaksi penguraian dapat dianggap sebagai kebalikan dari proses penggabungan.
Reaksi substitusi adalah reaksi kimia yang mengakibatkan penggantian atom atau gugus atom dalam suatu molekul suatu zat dengan atom atau gugus atom lain, misalnya:
Fe + 2HCl = FeCl 2 + H 2
Ciri khasnya adalah interaksi zat sederhana dengan zat kompleks. Reaksi serupa juga terjadi dalam kimia organik.
Namun, konsep “substitusi” dalam kimia organik lebih luas dibandingkan dengan kimia anorganik. Jika dalam molekul zat asal ada atom atau gugus fungsi yang digantikan oleh atom atau gugus lain, maka ini juga merupakan reaksi substitusi, meskipun dari sudut pandang kimia anorganik prosesnya terlihat seperti reaksi pertukaran.
- pertukaran (termasuk netralisasi).
Pertukaran reaksi adalah reaksi kimia yang terjadi tanpa mengubah bilangan oksidasi unsur-unsur dan mengakibatkan pertukaran bagian-bagian penyusun reaktan, misalnya:
AgNO 3 + KBr = AgBr + KNO 3

Jika memungkinkan, mengalirlah ke arah yang berlawanan
Jika memungkinkan, mengalir ke arah yang berlawanan - reversibel dan ireversibel.
Reversibel adalah reaksi kimia yang terjadi pada suhu tertentu secara bersamaan dalam dua arah berlawanan dengan kecepatan yang sebanding. Saat menulis persamaan untuk reaksi tersebut, tanda sama dengan diganti dengan panah yang berlawanan arah. Contoh paling sederhana dari reaksi reversibel adalah sintesis amonia melalui interaksi nitrogen dan hidrogen:
N 2 +3H 2 ↔2NH 3
Tidak dapat diubah adalah reaksi yang terjadi hanya dalam arah maju sehingga menghasilkan pembentukan produk yang tidak saling berinteraksi. Reaksi ireversibel meliputi reaksi kimia yang menghasilkan pembentukan senyawa yang sedikit terdisosiasi, pelepasan sejumlah besar energi, serta reaksi di mana produk akhir meninggalkan bidang reaksi dalam bentuk gas atau dalam bentuk endapan, misalnya :
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaBr

Oleh efek termal
Eksotermik disebut reaksi kimia yang terjadi dengan pelepasan panas. Simbol perubahan entalpi (kadar panas) ΔH, dan efek termal reaksi Q. Untuk reaksi eksotermik Q > 0, dan ΔH< 0.
Endotermik adalah reaksi kimia yang melibatkan penyerapan panas. Untuk reaksi endotermik Q< 0, а ΔH > 0.
Reaksi peracikan umumnya merupakan reaksi eksotermik dan reaksi penguraian bersifat endotermik. Pengecualian yang jarang terjadi adalah reaksi nitrogen dengan oksigen - endotermik:
N2 + O2 → 2NO – Q

Secara fase
Homogen disebut reaksi yang terjadi dalam medium homogen (zat homogen dalam satu fasa, misalnya g-g, reaksi dalam larutan).
Heterogen adalah reaksi yang terjadi dalam medium heterogen, pada permukaan kontak zat-zat yang bereaksi yang berbeda fasa, misalnya padat dan gas, cair dan gas, dalam dua cairan yang tidak dapat bercampur.
Sesuai dengan penggunaan katalis
Katalis adalah zat yang mempercepat reaksi kimia.
Reaksi katalitik hanya terjadi dengan adanya katalis (termasuk katalis enzimatik).
Reaksi non-katalitik pergi tanpa adanya katalis.
Berdasarkan jenis pesangon
Berdasarkan jenis pembelahan ikatan kimia pada molekul awal, reaksi homolitik dan heterolitik dibedakan.
Homolitik disebut reaksi di mana, sebagai akibat dari pemutusan ikatan, terbentuk partikel yang memiliki elektron tidak berpasangan - radikal bebas.
Heterolitik adalah reaksi yang terjadi melalui pembentukan partikel ionik - kation dan anion.
- homolitik (celah sama, setiap atom menerima 1 elektron)
- heterolitik (celah yang tidak sama - seseorang mendapat sepasang elektron)
Radikal(rantai) adalah reaksi kimia yang melibatkan radikal, misalnya:
CH 4 + Cl 2 jam →CH 3 Cl + HCl
ionik adalah reaksi kimia yang terjadi dengan partisipasi ion, misalnya:
KCl + AgNO 3 = KNO 3 + AgCl↓
Reaksi elektrofilik adalah reaksi heterolitik senyawa organik dengan elektrofil - partikel yang membawa muatan positif utuh atau pecahan. Reaksi ini dibagi menjadi reaksi substitusi elektrofilik dan adisi elektrofilik, misalnya:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C =CH 2 + Br 2 → BrCH 2 –CH 2 Br
Reaksi nukleofilik adalah reaksi heterolitik senyawa organik dengan nukleofil - partikel yang membawa muatan negatif utuh atau pecahan. Mereka dibagi menjadi reaksi substitusi nukleofilik dan adisi nukleofilik, misalnya:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
Klasifikasi reaksi organik
Klasifikasi reaksi organik diberikan dalam tabel:

Bagian I
1. Reaksi senyawa adalah“antonim kimia” dari reaksi dekomposisi.
2. Tuliskan tanda-tanda reaksi senyawa tersebut:
- reaksinya melibatkan 2 zat sederhana atau kompleks;
- satu kompleks terbentuk;
- panas dilepaskan.
3. Berdasarkan ciri-ciri yang diketahui, tentukan reaksi senyawa tersebut.
Reaksi senyawa adalah reaksi yang menghasilkan pembentukan satu zat kompleks dari satu atau lebih zat sederhana atau kompleks.
Berdasarkan arah reaksinya, reaksi dibedakan menjadi:

Bagian II
1. Tuliskan persamaan reaksi kimia:

2. Tuliskan persamaan reaksi kimia antara klorin:
1) dan natrium 2Na+Cl2=2NaCl
2) dan kalsium Ca+Cl2=CaCl2
3) dan besi dengan pembentukan besi (III) klorida 2Fe+3Cl2=2FeCl3
3. Jelaskan reaksinya

4. Jelaskan reaksinya

5. Tuliskan persamaan reaksi senyawa yang terjadi menurut skema:

6. Susunlah koefisien-koefisien pada persamaan reaksi yang diagramnya adalah:

7. Apakah pernyataan berikut ini benar?
A. Sebagian besar reaksi senyawa bersifat eksotermik.
B. Ketika suhu meningkat, laju reaksi kimia meningkat.
1) kedua penilaian itu benar
8. Hitung volume hidrogen dan massa belerang yang diperlukan untuk membentuk 85 g hidrogen sulfida.